Одной из основных проблем дерматовенерологии, гинекологии и урологии является лечение инфекций половых путей. Инфекции, передаваемые половым путем (ИППП), вызываются массой (более 30) разнообразных возбудителей (вирусных и бактериальных агентов, простейших, грибов и др.) и служат причиной значительной заболеваемости и серьезных нарушений репродуктивной функции человека [1].
Наряду с классическими ИППП, вызывающими такие заболевания, как сифилис и гонорея, во многих популяциях и социальных группах существенно выше распространенность уретритов и цервицитов, вызванных патогенными микроорганизмами «нового поколения» (Chlamydia trachomatis, Trichomonas vaginalis) [2].
Кроме того, половые пути и мужчин, и женщин часто колонизируются микоплазмами (уреаплазмами). Большинство микоплазм не является абсолютным патогеном. Передаваясь половым путем, они при определенных условиях вызывают инфекционно-воспалительные процессы в мочеполовых органах, чаще в ассоциации с другими патогенными или условно-патогенными микроорганизмами. В связи с этим микоплазмы описываются как «микроорганизмы на службе у болезни» и их относят к группе микроорганизмов-резидентов (т.е. постоянно присутствующих в урогенитальном тракте человека), ассоциированных с ИППП [3].
Как правило, именно эти бактериальные резиденты создают определенные трудности в интерпретации лабораторных результатов и зачастую, к сожалению, имеют широкую спекулятивную славу среди практикующих врачей в РФ.
Высокая распространенность микоплазменной инфекции (M. hominis, U. urealyticum) и частое ее выявление у практически здоровых лиц затрудняют решение вопроса о роли этих микроорганизмов в этиологии и патогенезе заболеваний урогенитального тракта.
Микоплазмы (Mycoplasma от греч. «mycos» – гриб, «plasma» – оформление) – мельчайшие микроорганизмы с наименьшим среди прокариот размером генома и чрезвычайно простой организацией клетки. Это группа весьма разнообразных и характерных по морфологии микроорганизмов, способных как к автономному росту, так и к паразитированию на мембране эукариотической клетки [2–4].
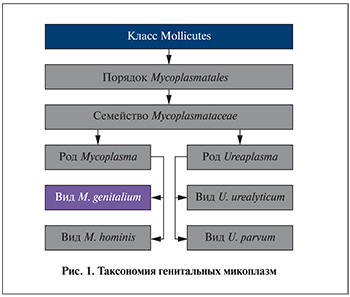 В соответствии со структурной организацией микоплазмы занимают промежуточное положение между бактериями и вирусами. Таксономия генитальных микоплазм представлена на рис. 1.
В соответствии со структурной организацией микоплазмы занимают промежуточное положение между бактериями и вирусами. Таксономия генитальных микоплазм представлена на рис. 1.
Историческая справка
Этапы изучения микоплазменной инфекции представлены в табл. 1.
В СССР 20.10.1983 были выпущены первые методические рекомендации «Лабораторная диагностика Ureaplasma urealyticum», утвержденные начальником Управления лечебно-профилактической помощи МЗ СССР А. Джорбенадзе, а 17.03.1988 – «Урогенитальные хламидиоз, уреаплазмоз, гарднереллез (диагностика, лечение, профилактика)», утвержденные начальником Главного управления лечебно-профилактической помощи МЗ СССР В. И. Калининым. В методических рекомендациях (Москва, 1988) было указано следующее: «Все лица, у которых обнаружены уреаплазмы, хламидии или гарднереллы, подлежат лечению. Во всех случаях лечения …независимо от методики проводится профилактика кандидоза: нистатин или леворин по 2,0 млн ЕД в сутки, или низорал по 0,2х2 раза в день. При вялопротекающих формах инфекции …в стационаре до антибиотикотерапии проводится иммунотерапия и местное лечение. В амбулаторных условиях в целях предотвращения распространения инфекции антибиотик назначается одновременно с иммунотерапией с последующим назначением местного лечения».
Впоследствии появился Приказ МЗ СССР «Обязательный статистический учет ИППП (с заполнением экстренного извещения): сифилис, гонорея, хламидиоз, трихомониаз, уреаплазмоз, микоплазмоз, кандидоз и гарднереллез» № 286 от 1993 г. Данный приказ был отменен только через 6 лет в 1999 г.

В 1995 г. в России была введена МКБ-X, согласно которой в классе А «Некоторые инфекционные и паразитарные болезни» имеется рубрика A49.3 «Инфекция, вызванная микоплазмой, неуточненная». С 2000 г. (приказ МЗ РФ № 315 от 07.08.2000) в связи с введением в России МКБ-X вызванные микоплазмами инфекции были исключены из списка заболеваний, которые регистрировались как ИППП.
Современное состояние проблемы
Итак, Mycoplasma hominis и Ureaplasma urealyticum – условно-патогенные микроорганизмы, реализация патогенных свойств которых происходит при определенных условиях (высокий уровень бактериальной обсеменности, иммуносупрессия и т.д.).
Вопрос о влиянии микоплазм (M. hominis, U. urealyticum) на репродуктивную функцию человека дискутируется. Женское бесплодие связано с воспалительными процессами гениталий, приводящими к нарушению или даже невозможности прохождения созревшей яйцеклетки в полость матки. Мужское бесплодие обусловлено, с одной стороны, воспалительными процессами, с другой – воздействием уреаплазм на сперматогенез и сперматозоиды. Патогенное действие уреаплазм связано с их способностью адсорбироваться на поверхности сперматозоидов, изменять их подвижность и морфологию, влиять на хромосомный аппарат [2–4].
M. hominis выявляют при бактериальном вагинозе в ассоциации с другими представителями вагинального нормоценоза: G. vaginalis, Bacteroides sp., Prevotella sрp., Peptostreptococcus sрp., Mobiluncus и др. В то же время M. hominis выделяют из уретры и прямой кишки у 20–75% здоровых лиц обоего пола. Не имеется достоверных доказательств патогенности M. hominis и не получено однозначного ответа на вопрос о значении M. hominis в развитии акушерско-гинекологической и неонатальной инфекционной патологии [3].

U. urealyticum впервые выделена в 1954 г. у пациента с негонококковым уретритом (НГУ). Название U. urealyticum обусловлено способностью микроорганизма гидролизировать мочевину с образованием аммиака, т.е. уреазной активностью. С 2002 г. из рода Ureaplasma выделено два отдельных вида: U. urealyticum (биовар Т960) и U. parvum (биовар Parvo) [3]. Таксономия генитальных микоплазм представлена на рис. 1.
У пациентов могут иметься одновременно несколько серотипов U. urealyticum (2, 4, 5, 7–13). Данные о возможной роли U. parvum в возникновении НГУ и других патологических процессов в настоящее время отсутствуют [5].
При этом связь U. urealyticum с острым НГУ отмечается в 5–10% наблюдений [6], доказано преобладание сероваров 2, 5, 8 и 9 U. urealyticum у больных негонококковым/нехламидийным уретритом [7], имеются предположения о возможной роли U. urealyticum в развитии хронического НГУ у мужчин [8]. Считается признанной роль U. urealyticum в нарушении репродуктивной функции мужчин (изменение морфологии сперматозоидов и потеря их подвижности).
Согласно последним рекомендациям Центра по контролю и профилактике заболеваний США (CDC, 2010) роль Ureaplasma spp. в развитии НГУ спорна [9].
Современные предположения относительно роли уреаплазм при НГУ следующие: U. urealyticum ассоциирована с НГУ; U. parvum – это «нормальная флора»; присутствие U. parvum маскирует ассоциацию U. urealyticum с НГУ; более ранние исследования, где не дифференцировали U. urealyticum от U. parvum, не могли выявить ассоциацию с НГУ.
В настоящее время вопрос о роли некоторых видов микоплазм (M. hominis, U. urealyticum) как моновозбудителя патологических процессов окончательно не решен. Позиции отечественных и зарубежных исследователей по данной проблеме достаточно противоречивы. Точных доказательств этиологической роли микоплазм в развитии многих предположительно связанных с ними воспалительных заболеваний органов малого таза пока не получено. Экспертами ВОЗ (2006) U. urealyticum определена как потенциальный возбудитель НГУ у мужчин и, возможно, воспалительных заболеваний органов малого таза (ВЗОМТ) у женщин. В то же время эксперты Центра по контролю и профилактике заболеваний США (CDC, 2010) не считают доказанной этиологическую роль и клиническое значение генитальных микоплазм (за исключением M. genitalium) [10].
Используя модифицированные постулаты Хенле-Коха (Henle-Koch, 1840), эксперты [3] в качестве доказательств роли микроорганизма в развитии заболевания приводят следующие причины:
- Микроорганизм выявляют чаще и/или в больших количествах у больных, чем у здоровых.
- Иммунологический ответ (антитела) при любых методах исследования выявляется у инфицированного хозяина.
- Клиническое и микробиологическое излечение антимикробными препаратами, к которым микроорганизм чувствителен in vitro.
- Микроорганизм способен инфицировать животное, от которого он может быть выделен, и вызывать болезнь, сходную с заболеванием человека.

Колонизация генитального тракта микоплазмами происходит после первого полового контакта и возрастает в зависимости от числа половых партнеров. По мере увеличения числа половых партнеров уровень колонизации возрастает быстрее у женщин, чем у мужчин, что свидетельствует о большей чувствительности женщин к этим микроорганизмам. У мужчин M. hominis чаще всего колонизирует уретру и крайнюю плоть, у женщин – влагалище, реже – шейку матки и уретру. Данные о распространении M. hominis среди населения разноречивы. Показатели инфицированности варьируются от 10 до 50%. Колонизация мочеполового тракта человека M. hominis и U. urealyticum зависит от возраста, социально-экономического положения и сексуальной активности, причем у женщин они выделяются чаще, чем у мужчин. При этом U. urealyticum выявляется в 2–3 раза чаще, чем M. hominis [3, 4].
Согласно данным мета-анализа, проведенного в Иране в 2016 г., распространенность урогенитальных микоплазм среди женщин и мужчин высока и колеблется от 2 до 41% и от 2 до 44% соответственно. Обобщенный показатель распространенности у мужчин составил 11,1% (95% ДИ – 7,4–16,4%), у женщин – 12,8% (95% ДИ – 9,8–16,5%). Распространенность урогенитальных микоплазм значительно выше у бесплодных мужчин по сравнению с мужчинами, имеющими детей. Авторы заключают, что поскольку урогенитальные микоплазмы могут играть определенную роль в мужском бесплодии, скрининг-стратегии (особенно у бессимптомных лиц), а также лечение инфицированных лиц представляются обоснованными [11].
В эпидемиологических исследованиях установлено, что чаще речь идет о бессимптомном или подостром течении уретрита, характеризующемся «утренней каплей», чувством зуда и дискомфорта. Возможно, микоплазменная инфекция играет определенную роль в развитии простатовезикулита и эпидидимита и инициирует пусковой механизм в патогенезе болезни Рейтера. К сожалению, в последние годы основательных исследований в этом направлении не проводилось.
Выявляемость наиболее распространенных патогенных микроорганизмов, выделенных от больных с НГУ, представлена в табл. 2 [12].
M. hominis и U. urealyticum могут в значительной степени определять неблагоприятные исходы беременности в тех случаях, когда присутствуют в верхнем, а не в нижнем отделе половых путей женщины, и повышать риск преждевременных родов и летального исхода при рождении детей с очень низкой массой тела [3].
Уреаплазменная инфекция нередко активизируется во время беременности и может стать причиной преждевременных родов и септических спонтанных абортов. В этих случаях U. urealyticum обнаруживают в организме плода и мертворожденных детей. Однако ни одно из наблюдений пока не дает однозначного ответа на вопрос, происходит ли гибель плода вследствие колонизации микоплазмами, или он погибает по другой причине с последующим внедрением микоплазм в мертвую ткань.
Заболевания, ассоциированные c генитальными микоплазмами, представлены в табл. 3 [13].
Таким образом, генитальные микоплазмы, включая М. hominis и U. urealyticum, находятся во влагалищной среде у 70–80% сексуально активных женщин [14]. Хотя в большинстве случаев наличие M. hominis и U. urealyticum не сопровождается какой-либо симптоматикой, эти инфекции связаны с повышенным риском неблагоприятных исходов беременности, таких как выкидыши, мертворождения и преждевременные роды. М. hominis связаны с такими состояниями, как эндометрит и преждевременные роды, в то время как U. urealyticum может обусловить хориоамнионит, спонтанный аборт, мертворождения, преждевременные роды и другую патологию беременности [15].
Способность Ureaplasma spp. и M. hominis вызывать пневмонию, бактериемию и менингит у новорожденных уже не может быть поставлена под сомнение. Существуют убедительные доказательства того, что уреаплазмы вызывают воспалительную реакцию в матке, что может приводить к хориоамниониту и хроническому поражению легких у новорожденных [16].
Согласно современной парадигме, М. hominis и U. urealyticum у женщин связаны с повышенным риском неблагоприятных исходов беременности, таких как выкидыши, мертворождения и преждевременные роды. При этом у мужчин эти инфекты не всегда проявляют себя клинически. В случае беременности очевидно, что женщин инфицируют их половые партнеры – мужчины. Таким образом, целесообразно проводить тестирование обоих партнеров перед предстоящим зачатием. Необходимо обследование мужчин на весь спектр урогенитальных инфекций для предотвращения инфицирования любым инфектом с целью профилактики нарушений репродуктивного здоровья у женщин.
В Китае была изучена взаимосвязь между микоплазменной инфекцией (M. hominis, U. urealyticum) и бесплодием у мужчин, пришедших на амбулаторный прием. Эпидемиологические данные, включая распространенность, распределение по возрасту и антибактериальный профиль резистентности больных U. urealyticum или M. hominis, были собраны в период между 2009 и 2012 гг. Среди 7000 обследованных мужчин 3225 (43,7%) пациентов оказались инфицированнными U. urealyticum, M. hominis и даже обеими микоплазмами. В положительных культурах U. urealyticum обнаруживали часто, в то время как М. hominis выявлялась довольно редко [17].
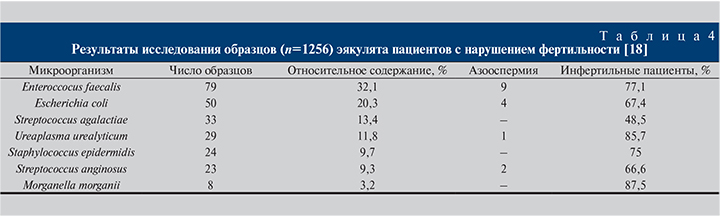
Большой интерес у специалистов-репродуктологов вызывают исследования, посвященные изучению различных показателей спермограммы при наличии инфекции или в ее отсутствие. Так, E. Moretti и соавт. исследовали 1256 образцов эякулята пациентов с нарушением фертильности и констатировали бактериальную контаминацию в 417 (33,2%) случаях (табл. 4). Идентификацию бактериальных культур проводили в 246 образцах, контрольная группа составила 20 человек [18].
J. Shi и соавт. [19] выявили перекрестные антигены у сперматозоидов и уреаплазм, в связи с этим авторы предполагают, что провоцируется образование антиспермальных антител. T. Wu и соавт. [20] полагают, что U. urealyticum прикрепляется к рецепторам сперматозоидов, которые принимают участие в прикреплении к мембране ооцита, и тем самым блокируют оплодотворение [20]. X. Xia и соавт. [21] указывают на нарушение целостности мембран сперматозоидов. Имеются единичные сведения, согласно которым нарушается акросомная реакция (меняется количество действующих акросом) при инкубации с U. urealyticum [22].
 Однако до последнего времени отсутствует четкое понимание патогенного механизма влияния U. urealyticum на сперматогенез и научная дискуссия по данной проблеме продолжается.
Однако до последнего времени отсутствует четкое понимание патогенного механизма влияния U. urealyticum на сперматогенез и научная дискуссия по данной проблеме продолжается.
Следует признать, что в последние годы наблюдается неуклонная тенденция к ассоциации возбудителей ИППП, возникновению сочетанных инфекций, что, несомненно, существенно ухудшает течение и прогноз заболевания. Наиболее вероятной причиной формирования ко-инфекций служит неэффективность антибактериальной терапии. Неправильный выбор препарата, его дозы, несоблюдение больным режима приема, как правило, приводят лишь к стиханию остроты процесса и его хронизации [23]. Кроме этого вероятно снижение чувствительности возбудителей к химиотерапии, мутации с формированием резистентных штаммов, устаревшие, малоинформативные методы диагностики [24].
По данным многих авторов, хламидии, вирусы, уреа- и микоплазмы практически не встречаются в качестве моновозбудителей воспалительных заболеваний гениталий, а, как правило, входят в состав сложных микробных ассоциаций. Так, в Москве микст-формы выявлены в 52% случаев, из них более чем в 1/3 (34,3%) имело место сочетание 3 и более возбудителей. Распространенность урогенитального хламидиоза в популяции пациентов с воспалительными заболеваниями гениталий составила 23,1%, уреа- и (или) микоплазмоза – 11,5%, вирусных инфекций – 3,2%, кандидоз половых органов отмечен в 33,1% случаев [25].
Для сравнения: в недавнем исследовании в Южной Корее среди женщин, обратившихся с жалобами, 91,7% обследованных с обнаруженными T. vaginalis были инфицированы другими патогенами: M. hominis была на 1-м месте, за ней следовали U. urealyticum и C. trachomatis [26].
В Японии 424 мужчины с симптомами острого уретрита были обследованы при помощи ДНК-диагностики уретральных мазков и проб мочи. Гонорея (Neisseria gonorrhoeae) была выявлена у 127 (30%) обследованных. Из 297 мужчин с НГУ C. trachomatis выявлена у 143 (48,1%). У 154 лиц с нехламидийным негонококковым уретритом были выявлены: M. genitalium (22,7%), M. hominis (5,8%), U. parvum (9,1%), U. urealyticum (19,5%), H. influenzae (14,3%), Neisseria meningitidis (3,9%), T. vaginalis (1,3%), Human adenovirus (16,2%), Herpes simplex-1 (7,1%) и Herpes simplex-2 (2,6%). Очевидно, что у мужчин с НГУ на основе только клинических данных трудно оценить микробиологическое разнообразие этиологических агентов [27].
Таким образом, данные, полученные в разных регионах мира, свидетельствуют о том, что значительная часть инфекционной патологии урогенитального тракта сочетанна. В связи с этим в случаях предполагаемого наличия ко-инфекции диагностика должна носить комплексный характер.
Согласно современным отечественным клиническим рекомендациям (РОДВК), показанием к обследованию на U. urealyticum и M. hominis является:
- наличие клинико-лабораторных признаков воспалительного процесса в области урогенитального тракта в отсутствие патогенных возбудителей ИППП.
В отсутствие клинических проявлений обследованию подлежат:
- пациенты с диагнозом «бесплодие»;
- пациенты, имеющие в анамнезе невынашивание беременности и перинатальные потери;
- доноры спермы [10].
С позиций доказательной медицины применение биологических, химических и алиментарных провокаций с целью повышения эффективности диагностики заболеваний, вызванных U. urealyticum и M. hominis, нецелесообразно [10].
С учетом высокой распространенности микоплазм в нижних отделах мочеполовой системы у практически здоровых лиц репродуктивного возраста, а также неуточненности их истинного этиологического значения проведение скринингового обследования на генитальные микоплазмы не целесообразно [10].
Лабораторная диагностика служит одним из ключевых факторов контроля за распространением ИППП на территории Российской Федерации. Установление точного этиологического диагноза и назначение адекватного лечения без лабораторного подтверждения не представляются возможными.
Современная лабораторная база располагает обширным арсеналом общеизвестных и инновационных технологий, которые могут быть с успехом использованы для диагностики ИППП. Из перечня проводимых диагностических исследований ИППП необходимо исключить рутинные, малоинформативные и несоответствующие современным требованиям методы и включить современные высокотехнологичные методы, обладающие высокой чувствительностью и специфичностью.
В настоящее время приоритетными в диагностике ИППП являются прямые методы исследования. Выявление возбудителя или его генетического материала служит абсолютным подтверждением диагноза.
Отсутствие четких морфологических характеристик, а также полиморфизм, присущий всему семейству микоплазм, исключает возможность идентификации возбудителя (М. hominis и U. urealyticum) в мазках от больных, поэтому микроскопический метод не используется.
Однако микроскопическое исследование клинического материала из уретры, влагалища и цервикального канала позволяет:
- оценивать состояние эпителия уретры, влагалища, цервикального канала;
- оценивать степень лейкоцитарной реакции;
- исключать сопутствующие ИППП (гонококковая инфекция, урогенитальный трихомониаз);
- оценивать состояние микробиоценоза влагалища [10].
Для выявления микоплазменной инфекции (М. hominis и U. urealyticum) применимы количественный (культуральный метод на плотных и жидких питательных средах) и качественный (полимеразная цепная реакция и другие способы амплификации ДНК и РНК) методы лабораторной диагностики с использованием тест-систем, разрешенных к медицинскому применению в РФ.
Другие методы лабораторных исследований, в том числе прямую иммунофлюоресценцию (ПИФ), иммуноферментный анализ (ИФА) для обнаружения антител к U. urealyticum и M. hominis, недопустимо использовать для диагностики заболеваний, вызванных U. urealyticum и M. hominis [10].
В настоящее время правомерна формулировка диагноза с учетом 2 рубрик: 1-я соответствует локализации воспалительного процесса, 2-я – В96.8 (другие бактериальные агенты как причина болезней, классифицированных в других рубриках). Пример: N34+B96.8 Уретрит, вызванный Ureaplasma spp. и/или M. hominis.
Большинство исследователей считают, что к критериям назначения этиологической терапии при выявлении генитальных микоплазм (М. hominis и U. urealyticum) относятся:
- клинические и лабораторные признаки воспалительного процесса в органах мочеполовой системы;
- результаты комплексного микробиологического обследования на наличие патогенных и условно-патогенных микроорганизмов с количественным обнаружением M. hominis и U. urealyticum >104 ЦОЕ/мл (маркером, который, как считается, отражает возможность уреаплазм реализовывать свои патогенетические свойства, является плотность обсемененности или бактериальная нагрузка, оцениваемые при бактериологическом посеве и выражающиеся в значениях цветоизменяющих единиц на 1 мл [ЦОЕ/мл]);
- предстоящие оперативные или другие инвазивные мероприятия на органах мочеполовой системы (гистероскопия, трансуретральная резекция, деструкция кондилом, введение внутриматочных контрацептивов, крио-, электро-, лазеротерапия эктопии шейки матки и др.);
- бесплодие, когда, кроме генитальных микоплазм, не установлено других его причин;
- оценка акушерско-гинекологического анамнеза, течения настоящей беременности. [3, 4, 6, 10].
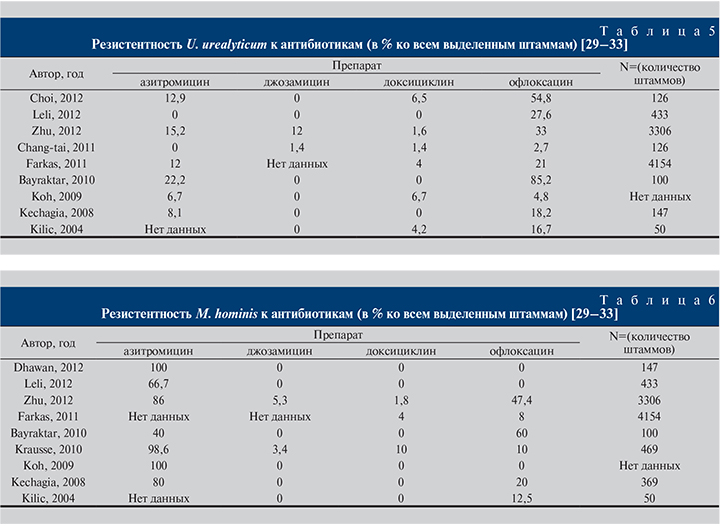
В Германии определена чувствительность 290 изолятов M. hominis и 179 изолятов уреаплазмы, выделенных в 1983–2004 гг., к 11 антибактериальным препаратам. Доксициклин был самым активным тетрациклином с MIC90 1 и 8 мг/л для уреаплазмы и M. hominis соответственно. Изоляты М. hominis гораздо чаще, чем изоляты уреаплазмы, были устойчивыми к тетрациклинам – в 10–13 и 1–3% случаев соответственно. Офлоксацин был эффективным против обоих видов (>95% восприимчивости). Ципрофлоксацин был умеренно активным в отношении М. hominis и менее активным в отношении уреаплазм – 70,3 и 35,2% восприимчивости соответственно. Кларитромицин и джозамицин были самыми мощными макролидами (MIC90 из 0,5 мг/л) против уреаплазмы. Эритромицин имел самую низкую активность (MIC90 8 мг/л) против уреаплазмы, как и клиндамицин, который был самым мощным средством против M. hominis. Перекрестная резистентность обнаружена между тетрациклинами (53–93%), макролидами и эритромицином (70–100%), а также между эритромицином и ципрофлоксацином (43–55%). М. hominis стала более устойчивой к тетрациклинам и фторхинолонам в период с 1989 по 2004 г., хотя в 2005–2008 гг. динамика показателя была незначительной. Доксициклин – по-прежнему препарат первой линии лечения уреаплазменной инфекции, который может быть использован для лечения совместной инфекции с М. hominis [28].
В Италии выявляли различия в распространенности и антимикробной восприимчивости U. urealyticum и M. hominis в популяции коренных итальянцев и иммигрантов. U. urealyticum и обе инфекции были более частыми у африканских пациентов: U. urealyticum – в 51,5 и 33,3% (р=0,046); сочетанная инфекция – в 54,5 и 34,3% (р=0,035). Изоляты U. urealyticum в 66,4% были устойчивыми к ципрофлоксацину, 27,6% – к офлоксацину. Среди изолятов М. hominis 66,7% были устойчивыми к азитромицину и рокситромицину.
В целом было показано, что распространенность генитальных микоплазм и профили устойчивости к антибиотикам изменяются в зависимости от страны происхождения [29].
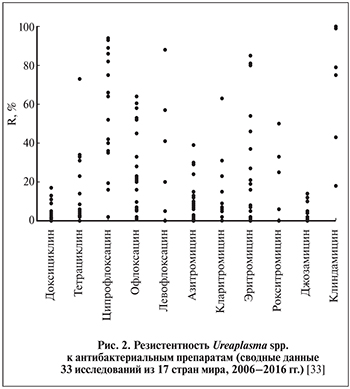
Результаты исследований (сводные данные 33 исследований из 17 стран мира, 2006–2016) по резистентности U. urealyticum и M. hominis к антибиотикам представлены в табл. 5–6 и на рис. 2 [29–33].
Таким образом, доксициклин по-прежнему остается препаратом выбора для уреаплазменной инфекции и одновременно эффективным в отношении M. hominis. Клиндамицин очень активный в отношении M. hominis и может использоваться в качестве альтернативы тетрациклинам. Джозамицин особенно рекомендуется беременным женщинам и новорожденным [28].
Определение чувствительности к антибиотикам следует проводить только при неэффективности терапии и рецидивировании воспалительного процесса [10].
Не обосновано назначение длительных или повторных курсов антибиотиков пациентам без клинических проявлений воспалительного процесса только на основании обнаружения микоплазменной инфекции. Вызывает сомнение целесообразность применения иммуностимуляторов без выявленных иммунологических нарушений, а также местного лечения микоплазенной инфекции (M. hominis и U. urealyticum) [10].
Основные требования к результатам лечения – это разрешение клинических и лабораторных признаков воспаления. Эрадикация M. hominis и U. urealyticum не является требованием к результатам лечения [10].
Таким образом, микоплазменная инфекция (M. hominis и U. urealyticum) остается основной загадкой в урологии и дерматовенерологии. Наряду с доказательствами причинной роли инфекции в развитии НГУ у мужчин и ВЗОМТ у женщин остаются неясными реальные патогенетические и патофизиологические механизмы воздействия инфектов на организм хозяина.
Заключение. В настоящее время вопрос о микоплазмах (M. hominis, U. urealyticum) как моновозбудителе патологических процессов окончательно не решен и дискуссия продолжается. Позиции отечественных и зарубежных исследователей по данной проблеме довольно противоречивы. Четких доказательств этиологической роли микоплазм в развитии многих предположительно связанных с ними воспалительных заболеваний пока не получено. Доксициклин и джозамицин являются препаратом выбора при наличии клинико-лабораторных признаков инфекционно-воспалительного процесса.


