Введение. В настоящее время минимально инвазивные операции широко применяются при оперативном лечении больных с опухолями надпочечника различного генеза. Первая лапароскопическая адреналэктомия (ЛАЭ) была выполнена M. Gagner и соавт. [1] в 1992 г. В последнее десятилетие наряду со стандартной ЛАЭ активно внедряются адреналэктомии, выполняемые мини-лапароскопическим, робот-ассистированным и однопортовым доступами [2–7]. В литературе встречаются публикации о результатах ЛАЭ при феохромоцитоме, кортизолсекретирующей аденоме, синдроме Кона, миелолипоме, а также первичных и метастатических опухолях надпочечника [8–13].
К сожалению, большинство адреналэктомий открытым и минимально инвазивным доступами производились в общехирургических отделениях [14–17]. Однако в последнее время количество ЛАЭ, выполненных в урологических клиниках, неуклонно растет. Этот факт объясняется накоплением достаточного опыта в лапароскопическом лечении заболеваний органов мочевыделительной системы.
Лапароскопическую адреналэктомию можно выполнить трансперитонеальным и ретроперитонеальным доступами, каждый из которых имеет свои преимущества и недостатки [7, 18, 19]. Однако опыт последних лет показывает, что чресбрюшинный доступ имеет такие преимущества, как большая рабочая полость, лучшая ориентация хирурга, хороший косметический эффект, минимальное послеоперационное обезболивание, снижение сроков госпитализации и реабилитации больных. Так, N. Pavan и соавт. [7] при выполнении 737 адреналэктомий в 533 (72%) случаях использовали трансперитонеальный доступ, в 204 (28%) – ретроперитонеальный. Выбор последнего, несомненно, определяется опытом и предпочтениями самого хирурга.
Цель исследования: изучить результаты ЛАЭ у больных с опухолями надпочечника.
Материалы и методы. В период с 2011 по 2016 г. в клинике урологии Северо-Западного ГМУ им. И. И. Мечникова на базе урологического отделения ГМПБ № 2 и городского онкологического диспансера ЛАЭ выполнена 24 больным. Среди них мужчин было 15, женщин – 9. Возраст прооперированных колебался от 36 до 78 лет, составив в среднем 49,6±8,2 года. Операция справа произведена 12 больным, слева – 10, билатеральная ЛАЭ – 2. Таким образом, 24 пациентам выполнено 26 ЛАЭ.
В предоперационном периоде обследование включило УЗИ и КТ брюшной полости, клинический и биохимический анализы крови, консультацию эндокринолога. Концентрацию кортизола в сыворотке крови определяли утром (8–9 ч), вечером (22–23 ч) и после внутримышечного введения 1 мг дексаметазона.
Показаниями к ЛАЭ в основном были первичные и метастатические опухоли надпочечников. Всем больным ЛАЭ выполняли трансперитонеальным доступом в положении на боку с использованием 4 троакаров. При ЛАЭ справа первый троакар 11 мм для лапароскопа устанавливали в правой подвздошной области. После инсуфляции брюшной полости газом СО2 до 12 мм рт.ст. установили два порта (6 и 11 мм) для рабочих инструментов по подключичной линии латеральнее и выше пупка и ниже реберной дуги, а четвертый троакар 6 мм – по задней аксиллярной линии. После мобилизации двенадцатиперстной и толстой кишки, краниальной ретракции печени осуществили идентификацию сосудов надпочечника, их клипирование и пересечение. При выделении надпочечниковой вены лучше ориентироваться на нижнюю полую вену, чтобы избежать ее травмы и интраоперационного кровотечения. Далее произвели мобилизацию надпочечника с клипированием дополнительных сосудов. В конце операции после тщательного гемостаза макропрепарат помещали в эндомешок и извлекали через порт лапароскопа.
Локализация троакаров при ЛАЭ слева была идентичной таковой при операции справа. После мобилизации толстой кишки пересекали селезеночно-кишечную и диафрагмально-кишечную связки, вскрывали фасцию Герота. Дальнейшая мобилизация левой почечной вены облегчает выделение нижней надпочечниковой вены, которую клипировали и пересекали. Далее по ходу аорты мобилизовали надпочечник, выделили идущие к нему сосуды и клипировали их. Удаленный надпочечник вместе с окружающей жировой клетчаткой извлекли с помощью эндомешка.
В послеоперационном периоде проведены антибактериальная и симптоматическая терапия, контроль гемодинамических показателей, патогистологическое исследование удаленного препарата. После билатеральной ЛАЭ назначили заместительную гормональную терапию, которая подбиралась эндокринологом на основании данных анализа крови об уровне кортизола.
Результаты. Двадцати четырем больным были успешно выполнено 26 ЛАЭ. Конверсий не было. Гемотранфузия проведена только одной пациентке (2 года назад перенесла лапароскопическую нефрэктомию слева по поводу почечно-клеточного рака), у которой имело место кровотечение из-за травмы селезенки при ЛАЭ слева. У нее же в послеоперационном периоде развился острый панкреатит, проведена консервативная терапия.
Средний объем интра- и послеоперационной кровопотери составил 160 (120–750) мл, продолжительность операции – 135 (100–205) мин, сроки госпитализации – 4 (3–5) дня. При гистологическом исследовании в 20 (73,1,8%) удаленных надпочечниках выявлена аденокарцинома, в 6 (26,9%) – аденома.
Приводим одно из клинических наблюдений успешной ЛАЭ при метастатическом поражении единственного контралатерального надпочечника.
П а ц и е н т К. 60 лет в плановом порядке госпитализирован в клинику урологии с диагнозом «образование единственного левого надпочечника». Ранее (5 лет назад) перенес радикальную нефрэктомию справа с адреналэктомией по поводу опухоли почки. Далее в связи со стриктурой левого пиелоуретерального сегмента выполнены лапароскопический уретеролиз и стентирование мочеточника. Результаты данной операции были неудовлетворительными, поэтому произведена открытая пиелопластика по Хайнс–Андерсену. В последующем неоднократно выполнялась КТ брюшной полости, но данных за опухоль левого надпочечника не было. При контрольной КТ перед госпитализацией выявлено образование левого надпочечника размером 3,5×3,0 см (см. рис. 1, а). В латеропозиции больного установлено 4 троакара, выделены почечная и нижняя надпочечниковая вены. Последняя клипирована и пересечена. Далее клипированы остальные сосуды надпочечника, который вместе с опухолью и окружающей жировой клетчаткой помещен в эндомешок и извлечен через мини-лапаротомную рану. При осмотре макропрепарата визуализировалась опухоль надпочечника диаметром 3,5 см (см. рис. 1, б). Гистологическое заключение: светлоклеточная аденокарцинома. В настоящее время состояние стабильное, получает заместительную гормональную терапию. При контрольных обследованиях на КТ с внутривенным контрастированием функция единственной левой почки удовлетворительная, данных за рецидив опухоли не получено (см. рис. 1, в).
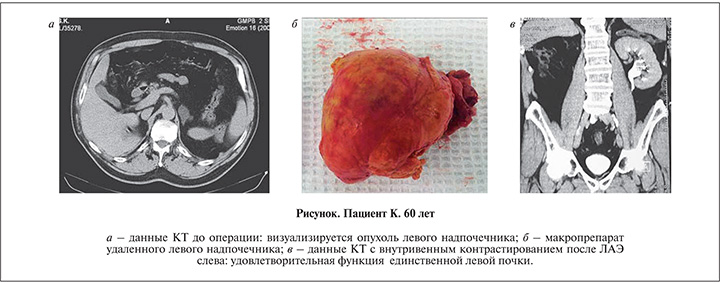
В представленном наблюдении использование современной лапароскопической техники позволило радикально удалить левый надпочечник с опухолью и реабилитировать больного в кратчайшие сроки.
У одного пациента после билатеральной ЛАЭ через 3 мес на фоне артериальной гипотензии развилась острая почечная недостаточность, что было связано с самостоятельной отменой приема гидрокортизона. Пациент был госпитализирован в Нефрологический центр, после стабилизации гемодинамических показателей функция единственной почки восстановлена. В настоящее время он регулярно принимает гидрокортизон, показатели гемодинамики стабильные.
Обсуждение. В настоящее время ЛАЭ активно применяется при хирургическом лечении больных с опухолями надпочечника. Первая работа о результате подобной операции опубликована в 1992 г. [1]. По данным большинства авторов, показаниями к ЛАЭ являются феохромоцитома, кортизолсекретирующая аденома, синдром Крона, миелолипома, а также метастатические поражения надпочечника [2–8, 13].
К противопоказаниям ЛАЭ могут быть отнесены местнораспространенная адренокортикальная карцинома, большие опухоли надпочечника (более 10–12 см), злокачественная адренокортикотропинсекретирующая феохромоцитома с лимфоаденопатией или адренокортикотропная карцинома с тромбом в нижней полой вене. На выбор хирургического доступа несомненно оказывает размер опухоли надпочечника. На ранних этапах внедрения ЛАЭ большинство хирургов прибегали к этой операции при размере опухоли до 5–6 см.
Накопление определенного опыта привело к увеличению лимита максимального размера до 10–12 см [20]. Использование лапароскопического доступа при опухолях большего диаметра сомнительно, так как, несмотря на их резектабельность, диссекция опухоли может быть сложной, длительной по времени и неудобной из-за ограниченной рабочей полости. Кроме того, опухоли с диаметром более 6–8 см имеют высокий риск малигнизации, поэтому многие авторы предлагают выполнять ЛАЭ при опухолях менее 7 см [12, 20].
В течение длительного времени хирургическое лечение опухолей надпочечника не проводилось урологами. Эти операции в большинстве случаев выполнялись в общехирургических отделениях [11, 12, 14]. Однако число адреналэктомий, выполненных урологами, неуклонно растет за последнее десятилетие. Об этом свидетельствуют результаты некоторых национальных регистров по хирургическому лечению опухолей надпочечника. Среди них можно отметить данные межцентровых исследований из Германии, Испании, Скандинавии и США [21–23]. Так, M.F. Monn и соавт. [23] проанализировали результаты адреналэктомий в США за 2002–2011 гг., использовав данные Nationwide Inpatient Sample. Минимально инвазивный хирургический доступ использовался в 20% случаев из 58 948 адреналэктомий. Они установили, что количество эндовидеохирургических адреналэктомий за изучаемый период выросло на 4% (р<0,001). Используя аналогичную базу данных (за 1999–2005 гг.), H.S. Park и соавт. [17] отметили, что опыт оперирующего хирурга, а не его специальность (общий хирург или уролог) оказывает влияние на количество интра- и послеоперационных осложнений. J. Simhan и соавт. [24] провели анализ результатов 8381 адреналэктомии, выполненной в госпиталях трех штатов США с 1996 по 2009 г. По их данным, с каждым годом количество подобных операций в госпиталях с низким опытом снижалось на 13%, а показатели смертности и послеоперационных осложнений закономерно уменьшалось при лечении в стационарах с достаточным опытом. F. Greco и соавт. [22], изучив результаты 363 ЛАЭ из 23 клиник Германии, сделали следующий вывод: ЛАЭ, выполненная урологами, имевшими достаточный опыт в лапароскопии, может быть безопасной и эффективной при удалении доброкачественных и злокачественных опухолей надпочечника.
За прошедшую последнюю декаду наряду с общепринятой ЛАЭ урологами были внедрены другие минимально инвазивные хирургические техники. Частота использования робот-ассистированной лапароскопической адреналэктомии (РЛАЭ) постепенно растет наряду с активным внедрением и применением роботической техники при оперативном лечении заболеваний почек, простаты и мочевого пузыря. По данным [7], в основном РЛАЭ выполнялась в клиниках США, где распространение роботических платформ сравнительно больше, чем в других регионах мира. Среди больных, которым была выполнена адреналэктомия, высокий индекс массы тела выявлен в группе РЛАЭ (средний – 30,3 кг/м2), который был статистически значимо выше по сравнению с другими малоинвазивными методами (р<0,001). Этот факт авторы объясняют тем, что РЛАЭ в основном выполняют в клиниках США, где превалируют пациенты с ожирением [7]. Недавно опубликованы рекомендации общества гастроинтестинальных и эндоскопических хирургов, которые поддерживают использование робот-ассистированной лапароскопии у пациентов с высоким ИМТ [25]. Однако, по данным [7], в группе РЛАЭ была высокая (55%) доля инцидентально диагностируемых опухолей надпочечника с небольшими средними размерами (2,7 см).
В литературе имеются публикации о результатах однопортовой ЛАЭ [2, 7, 26]. Недавний мета-анализ показал, что этот доступ может быть безопасной и возможной альтернативой стандартной ЛА с менее выраженной послеоперационной болью, но длительным временем операции. За период с 2008 по 2013 г. количество однопортовых ЛАЭ увеличилось на 6% в год относительно других минимально инвазивных методов лечения. Однако к данной операции чаще прибегали при доброкачественных опухолях надпочечника [7]. Однопортовую адреналэктомию легче выполнять слева, чем справа [2, 26]. При ЛАЭ также можно использовать мини-лапароскопический доступ. Недавно проведенный Европейский мультиинститутский анализ показал, что широкий спектр урологических операций можно безопасно и эффективно выполнять с помощью мини-лапароскопии [27].
В нашей серии у 18 (75%) больных ЛАЭ выполнялась по поводу метастаза опухоли почки в надпочечник, который был диагностирован через 5–8 лет после радикальной нефрэктомии. У 2 пациентов имело место опухолевое поражение обоих надпочечников, у 4 – метастаз в противоположный надпочечник. Появление образования надпочечника при наличии в анамнезе рака почки еще не указывает на его метастатический характер.
К сожалению, такие современные методы исследования, как МСКТ или МРТ, не позволяют верифицировать характер опухоли. Гормонально неактивные образования надпочечников (кисты, аденомы, миелолипома, гемангиома, рак или метастазы злокачественных образований) не имеют каких-либо специфических признаков, которые позволили бы отличить их друг от друга и от гормонально активных опухолей. Однако наличие в анамнезе злокачественной опухоли, в особенности рака почки, и образования надпочечника с большей долей вероятности указывает на его метастатический характер и требует проведения хирургического вмешательства [8]. Так, в нашей серии у 20 (83,3%) из 24 больных в анамнезе был рак почки и у 18 (75%) из них был выявлен метастаз в надпочечник, в том числе у 2 (8,3%) – билатеральный. У остальных 6 (25%) больных, из которых двое были ранее оперированы по поводу рака почки, диагностирована доброкачественная опухоль.
Заключение. Лапароскопическая адреналэктомия является методом выбора при оперативном лечении больных опухолями надпочечников различного генеза. Выбор доступа зависит от опыта и предпочтений хирурга, а также от технической оснащенности клиники.


