Тератозооспермия может быть определена как аномальная морфология сперматозоидов, которая влияет на фертильность мужчин. Действующее руководство ВОЗ пятого издания (2010) определяет пороговое значение в 4% морфологически нормальных форм как нижний 5-й процентиль когорты мужчин, достигших беременности у супруги за ≤12 мес. На практике это означает, что большинство фертильных мужчин будут иметь более высокий процент морфологически нормальных сперматозоидов. Большинство обследованных мужчин, зачавших в течение года, имели 15% нормальных форм по строгим критериям (медианный 50-й процентиль) [1]. Следует подчеркнуть, что эталонные значения параметров спермы не совпадают с минимальными, необходимыми для зачатия. Мужчины с переменными значениями вне контрольных диапазонов могут быть фертильными. И наоборот, пациенты со значениями в контрольном диапазоне все еще могут оставаться бесплодными [2].
Первоначально строгая морфологическая система оценки сперматозоидов была разработана как прогностический инструмент успеха экстракорпорального оплодотворения (ЭКО). В 1986 г. T. Kruger и соавт. [3] описали критерии классифицирования сперматозоидов (критерии Крюгера/Тигерберга). В случае если нормальные формы составляли от 0 до 4%, шансы на репродуктивный успех были низкими, в диапазоне от 5 до 14% – пограничными, выше 14% – высокими [3]. В упомянутом выше руководстве ВОЗ (2010) рекомендовано использовать строгие критерии для определения нормального сперматозоида и дано точное его определение, а также представлены схематичные рисунки различных дефектов [4, 5]. В некоторых странах применяются другие классификации. Например, модифицированную классификацию Дэвида использует подавляющее большинство лабораторий Франции. Данная классификация включает очень подробное фенотипирование, но подвергается критике, поскольку определяет «пограничные формы и субформы» как нормальные [6, 7]. На самом деле именно критерии «пограничного» внешнего вида сперматозоида в определении его нормальности вызывают основные прения и меняются с течением времени [5].
Общее снижение качества спермы за последние полвека стало предметом жарких дискуссий, хотя заметная часть обсуждений была сосредоточена на снижении количества сперматозоидов [8, 9]. Так, за последние 20 лет сообщается о снижении нормальных форм на 0,3–1,04% в год в популяции здоровых доноров [10, 11].
К предполагаемым причинам такого резкого снижения качества сперматозоидов в популяции мужчин за последние годы относят [6, 8, 12]:
- внедрение строгих критериев оценки (классификационный дрейф);
- выявление и введение с течением времени новых критериев для морфологических аномалий сперматозоидов;
- истинное снижение из-за влияния негативных факторов окружающей среды.
Оценка и клиническое значение морфологии сперматозоидов всегда были и остаются предметом обсуждения, поскольку исследование расценивается как субъективное, выполняемое под контролем человеческого глаза. Даже сегодня большинство современных компьютерных систем анализа морфологии сперматозоидов по-прежнему в значительной степени зависят от навыков оператора и страдают от тех же технических проблем, что и Руководство по оценке морфологии сперматозоидов. Это связано с методами подготовки, фиксации и окрашивания мазков спермы, которые оказывают серьезное влияние на результаты оценки морфологии сперматозоидов [13, 14]. Вопрос ухудшения качества спермы, включая морфологию сперматозоидов, приобретает важное значение из-за признания нескольких других текущих тенденций. К ним относят снижение не только количества и качества сперматозоидов, но и общего репродуктивного здоровья, включая увеличение выявленных случаев рака яичек и крипторхизма на фоне общего увеличения тестикулярной дисфункции (концепция синдрома дисгенезии яичек) [15, 16].
Прогностическая значимость морфологии сперматозоидов
Высказано предположение, будто потеря прогностической ценности доли нормальных форм (НФ) сперматозоидов по большей части обусловлена классификационным дрейфом во временной перспективе. Когда морфология сперматозоидов оценивалась менее строго, меньшее количество мужчин имели тератозооспермию, но морфология была прогностическим инструментом. Авторы связывают классификационный дрейф с изменениями в технике подготовки перпаратов, методах обучения и отсутствием единого международного стандарта для определения нормальных форм [12].
Естественное планирование. Вполне вероятно, что методы вспомогательных репродуктивных технологий (ВРТ) применяются несколько поспешно и следует обсудить с пациентом альтернативные методы терапии [17]. В единственном доступном нам на сегодняшний день исследовании, рассматривающем естественное планирование при выраженной изолированной тератозооспермии [17], продемонстрировано, что мужчины с полным отсутствием нормальных форм (0%) по строгой морфологии имеют достаточно высокие показатели достижения беременности без применения ЭКО, что идет вразрез с устоявшейся догмой о необходимости методов ВРТ при выраженной тератозооспермии [2, 5].
Внутриматочная инсеминация (ВМИ). Показано, что результаты ВМИ сильно зависят от количества подвижных сперматозоидов, оставшихся после подготовки, и минимальный порог составляет 1 млн (ВОЗ, 2010). Никаких рекомендаций касаемо морфологии нет, а влияние процента нормальных форм на частоту достижения беременностей путем ВМИ все еще обсуждается [4, 5]. В большинстве ранних работ обнаружено значительное влияние морфологии на частоту беременности [18–20]. Недавние же исследования (с 2012 г.) по этому вопросу не выявили существенных различий в показателях беременности в циклах ВМИ между группами с и без тератозооспермии, что может быть связано с классификационным дрейфом [21–23]. S. Shabtaie и соавт. [21] рекомендуют обсудить с пациентом при изолированной тератозооспермии естественное планирование или предложить по меньшей мере 2–4 цикла ВМИ при условии отсутствия женского фактора бесплодия. Авторы придерживаются мнения, согласно которому мужчины с аномальной морфологией (<4% нормальных форм) могут быть кандидатами на ВМИ при нормальной концентрации и подвижности сперматозоидов даже в случаях тяжелой тератозооспермии (0–1% нормальных форм по строгим критериям) и иметь репродуктивный успех [21]. Консенсус относительно пороговых значений морфологических форм при изолированной тератозооспермии не достигнут. На наш взгляд, попытки ВМИ целесообразны только в случае, если пара в беседе настаивает на наименее дорогостоящем или минимально инвазивном методе преодоления бесплодия.
ЭКО против ИКСИ. Большинство опубликованных исследований показало, что тератозооспермия влияла на результаты классического экстракорпорального оплодотворения (ЭКО) и в связи с этим рекомендуется интрацитоплазматическая инъекция сперматозоида (ИКСИ) ниже порога 5% для НФ независимо от значений концентрации и подвижности сперматозоидов [5, 18–20]. Особый интерес представляют исследования, где рассмотрены как ЭКО, так и ИКСИ. Hotaling и соавт. [24] оценили влияние тератозооспермии (<5% нормальных форм) на результаты ЭКО с ИКСИ и без него. Установлено, что изолированная тератозооспермия не ассоциировалась со сниженной вероятностью достижения беременности при применении любого из методов ВРТ. В других работах отмечено, что в обычных циклах ЭКО уровень оплодотворения ниже у пар с изолированной тератозооспермией по сравнению с ИКСИ. Однако ИКСИ не улучшало качество эмбриона, скорость образования бластоцисты и самый главный (целевой) исход – частоту достижения беременности и рождений в супружеских парах с изолированной тератозооспермией [24–27]. Таким образом, оценка морфологии сперматозоидов не имеет очевидных преимуществ для прогнозирования качества эмбриона, частоты клинической беременности и живорождений в циклах ЭКО или ИКСИ [27]. На практике в случаях мужского бесплодия выбор между ВМИ, ЭКО или ИКСИ редко зависит от морфологии, потому как, с одной стороны, нет никаких четких рекомендаций, с другой – тератозооспермия очень часто связана с тяжелой олигоастенозооспермией (ОАТ-синдром), что служит непосредственным показанием к ИКСИ [5].
О чем может рассказать фенотип сперматозоида?
В отличие от отклонений результатов цитологических исследований и анализа крови, указывающих на специфическое заболевание, аномальная морфология сперматозоидов является отражением негативных факторов, воздействующих на организм, зачастую без связи и не влияя на общее состояние здоровья конкретного мужчины [8].
Мономорфная тератозооспермия. В некоторых образцах определенное нарушение морфологии выявляется в подавляющем большинстве либо тотально во всех сперматозоидах (гомогенная или мономорфная тератозооспермия). Эти атипии могут быть названы системными или синдромными, так как фенотип сперматозоидов не меняется со временем, не поддается терапевтической коррекции и сходен с атипиями пациентов с аналогичными нарушениями фертильности. В данном случае аномалии носят семейный характер и имеют доказанное (или предполагаемое) генетическое происхождение [28]. К этим аномалиям относятся глобозооспермия, синдром короткого хвоста, микро-, макро- и ацефалия, а также маленькая акросомная область [29, 30]. Эти патоформы не могут быть изменены под влиянием окружающей среды и легко распознаются, хотя имеются данные об ассоциации между генетически обусловленными дефектами, образом жизни или факторами окружающей среды и аномальной морфологией сперматозоидов [31]. Другие гомогенные формы могут быть вызваны приемом лекарственных средств, например мегалоцефалия при использовании сульфасалазина для лечения язвенного колита и болезни Крона [32]. Гомогенные аномалии сперматозоидов могут быть связаны с более высокой частотой хромосомных аномалий. Мужчины с определенным типом тератозооспермии (макроцефальные, мультифлагеллярные сперматозоиды) имеют очень высокую частоту анеуплоидной и полиплоидной спермы (в 2–3 раза выше) [33, 34].
Полиморфная тератозооспермия. В случае когда популяция сперматозоидов представляет собой изолированную «полиморфную тератозооспермию», где большинство сперматозоидов проявляют более одного типа аномалий, наиболее вероятны общие повреждающие механизмы, которые могут быть вызваны плохими условиями окружающей среды, а не программные дефекты во время мейоза [35]. Так, относительное удлинение головки обычно определяется как аморфное нарушение, вызванное оксидативным стрессом, и особенно распространено в присутствии инфекции добавочных половых желез и при варикоцеле [36, 37]. Низкие показатели оплодотворения в циклах ВРТ были отмечены у мужчин с сильно удлиненными сперматозоидами и в случае наличия цитоплазматической капли из-за способности таких сперматозоидов генерировать высокие уровни АФК [38]. Существенно повышенное содержание АФК также наблюдали при увеличении доли сперматозоидов с аномалиями хвоста. Закручивание хвоста вокруг головки (спиралевидный хвост) наблюдали у интенсивных курильщиков и при варикоцеле – состояниях, тесно связанных с оксидативным стрессом. В двух крупных исследованиях с возрастанием доли закрученных хвостов возрастало и время достижения естественной беременности [39, 40]. Ни одна фенотипическая аномалия не способна разграничить фертильных и бесплодных мужчин. Однако высокая встречаемость некоторых ключевых категорий нарушений может отражать общие изменения в процессе сперматогенеза с функциональными последствиями, приводящими к более низкой вероятности естественного зачатия в течение короткого периода времени или более низкой частоте оплодотворения [2, 36]. В идеале корреляция фенотипа сперматозоидов должна дать ответ о стратегии преодоления бесплодия и отвечать на многие вопросы: есть ли риск повышенной анеуплоидии и целесообразно ли выполнять ИКСИ или биопсию яичка, требуется ли предимлантационная генетическая диагностика (ПГД)? На данный момент в этом ключе можно говорить только о генетически обусловленных фенотипах: определенные стратегии разработаны для глобулозооспермии и макроцефалии, ИКСИ противопоказано пациентам с гомозиготной мутацией AURKC (макрозооспермия) и биопсия яичка не рекомендована мужчинам с делециями AZFa или b [41]. Вместе с тем, несмотря на научный интерес к фенотипам сперматозоида, который позволяет предположить этиологию нарушения морфологии, руководством ВОЗ (2010) не рекомендовано рутинное фенотипирование [4]. На практике встретить в заключение подробное описание фенотипов сперматозоидов, присутствующих в эякуляте, возможно только от лабораторий, работающих с классификацией Дэвида.
Окислительный стресс и последующая фрагментация ДНК. Есть ли связь с морфологией?
В нескольких исследованиях отмечена связь между морфологией сперматозоидов и АФК, присутствующими в сперме [39, 42]. Контролируемое исследование [39] показало, что пациенты с высокими значениями АФК имели более низкий процент сперматозоидов с нормальной и пограничной морфологией. Положительная корреляция наблюдалась между АФК и процентом сперматозоидов с аморфными головками, повреждениями акросомы, цитоплазматической каплей, дефектами средней части и хвоста, а также c индексом деформации сперматозоидов [39]. В работе [43] в группе мужчин с тератозооспермией (<4% нормальных форм) наблюдали значительно более высокие уровни АФК по сравнению с группой здоровых доноров. Авторы решительно поддерживают гипотезу о существовании прямой связи между морфологией сперматозоидов и окислительно-восстановительным балансом. Помимо внешних и внутренних системных факторов, учавствующих в усиленной продукции АФК, аномальные сперматозоиды сами по себе считаются основным источником свободных радикалов [43]. Из-за сбоев в процессе сперматогенеза возникают аномалии хвоста, неполное развитие акросомы или изменения в цитоскелете сперматозоида, что мешает клеткам Сертоли фагоцитировать остаточную цитоплазму. Эта резидуальная цитоплазма рассматривается как наиболее важное звено в производстве АФК, а также как одна из основных причин последующего образования морфологически аномальных сперматозоидов [38, 43].
Повышенное производство АФК морфологически аномальными сперматозоидами и/или снижение антиоксидантной способности семенной плазмы служат возможной причиной повреждения ДНК. Опубликованные к настоящему времени данные о взаимосвязи между целостностью ДНК спермы и нормальной морфологией противоречат друг другу. Одни исследователи считают, что аномальная морфология сперматозоидов и повреждение ДНК связаны [43, 44], другие же какой-либо связи между этими параметрами не выявили [45, 46]. В российском исследовании повышенное количество сперматозоидов с фрагментированной ДНК обнаружено у 87% пациентов с тотальной тератозооспермией. Среди мужчин с различным количеством атипичных сперматозоидов встречаемость повышенного уровня фрагментации ДНК линейно зависит от количества аномальных гамет. Таким образом, авторами показано, что количество атипичных сперматозоидов, по крайней мере в диапазоне от 80 до 100%, коррелирует с частотой фрагментации ДНК. Однако исследователи отмечают, что у 37% мужчин с тератозооспермией не было выявлено повреждений ДНК [47].
Терапевтические возможности. Есть ли место антиоксидантам?
Мужское бесплодие неизвестного происхождения очень трудно поддается терапии. Конкретные терапевтические решения применяются только примерно к 20% известных причин мужского бесплодия. Так, гипергонадотропный гонадизм, урогенитальные инфекции, эректильная дисфункция, анэякуляция и ятрогенная ретроградная эякуляция являются теми немногими областями, где медикаментозная терапия оказалась успешной в восстановлении мужской фертильности [48].
Специфических методов терапии изолированной тератозооспермии не существует. Лекарственная терапия не должна использоваться пациентами с известными генетическими факторами, такими как аномалии кариотипа или делеция Y-хромосомы [41]. Следовательно, необходимо всесторонне обследовать мужчину и определить, в каких случаях медикаментозная терапия могла бы быть эффективной, а в каких необходимо обратиться к вспомогательной репродукции. При выявлении возможных причин тератозооспермии проводится их этиотропная терапия (варикоцеле, инфекции и т.д.) Также даются общие рекомендации по коррекции образа жизни, направленные на минимизацию интоксикаций и других вредных воздействий на сперматогенез [42]. Обычно изменения, вызванные экзогенными факторами, обратимы и желанная беременность достигается после назначения этиотропной или эмпирической терапии или оперативного вмешательства [5]. Убедительная связь морфологических аномалий сперматозоидов с оксидативным стрессом и дефицитом антиоксидантной активности эякулята в общей когорте мужчин служит обоснованием для назначения антиоксидантов [42, 43]. В отсутствие эффекта от проводимой терапии решается вопрос об ИКСИ [5].
 Антиоксиданты. В образцах с плохой морфологией и нарушенным уплотнением хроматина сперматозоида антиоксиданты могут защищать ДНК спермы как от эндогенной продукции АФК, так и от экзогенных неблагоприятных факторов, истощающих антиоксидантный запас сперматозоида. Содержание антиоксидантов в семенной плазме невелико. Cперматозоиды также нуждаются в дополнительной системе антиоксидантной защиты, собственный антиоксидантный буфер не в состоянии предотвращать перекисное окисление хвостовых и акросомных мембран [39–42]. Наибольшее количество исследований о связи с морфологией сперматозоида коснулось коэнзима Q10 (CoQ10; убихинол). За счет улучшения общей антиоксидантной активности CoQ10 улучшает ключевые параметры спермы: количество, подвижность и морфологию сперматозоидов. В двойном слепом контролируемом исследовании анализ корреляционных коэффициентов выявил положительную связь между продолжительностью лечения убихинолом и морфологией сперматозоидов (r=0,57, p=0,027) [49]. Другое клиническое исследование выявило значительное увеличение антиоксидантной активности (p<0,05) с улучшением морфологии. Потребление убихинола с пищей в 10 раз меньше исследуемых доз, показавших эффективность, чего явно недостаточно [50]. Существует выраженная положительная корреляция содержания свободного L-карнитина в эякуляте с нормальной морфологией сперматозоида (p<0,01) [51]. Цинк необходим для поддержания стабильности хроматина и мембраны сперматозоида, участвуя таким образом в сохранении НФ. В работе [52] показано, что добавка цинка значительно увеличивает объем спермы, подвижность сперматозоидов и долю нормальных форм.
Антиоксиданты. В образцах с плохой морфологией и нарушенным уплотнением хроматина сперматозоида антиоксиданты могут защищать ДНК спермы как от эндогенной продукции АФК, так и от экзогенных неблагоприятных факторов, истощающих антиоксидантный запас сперматозоида. Содержание антиоксидантов в семенной плазме невелико. Cперматозоиды также нуждаются в дополнительной системе антиоксидантной защиты, собственный антиоксидантный буфер не в состоянии предотвращать перекисное окисление хвостовых и акросомных мембран [39–42]. Наибольшее количество исследований о связи с морфологией сперматозоида коснулось коэнзима Q10 (CoQ10; убихинол). За счет улучшения общей антиоксидантной активности CoQ10 улучшает ключевые параметры спермы: количество, подвижность и морфологию сперматозоидов. В двойном слепом контролируемом исследовании анализ корреляционных коэффициентов выявил положительную связь между продолжительностью лечения убихинолом и морфологией сперматозоидов (r=0,57, p=0,027) [49]. Другое клиническое исследование выявило значительное увеличение антиоксидантной активности (p<0,05) с улучшением морфологии. Потребление убихинола с пищей в 10 раз меньше исследуемых доз, показавших эффективность, чего явно недостаточно [50]. Существует выраженная положительная корреляция содержания свободного L-карнитина в эякуляте с нормальной морфологией сперматозоида (p<0,01) [51]. Цинк необходим для поддержания стабильности хроматина и мембраны сперматозоида, участвуя таким образом в сохранении НФ. В работе [52] показано, что добавка цинка значительно увеличивает объем спермы, подвижность сперматозоидов и долю нормальных форм.
Наибольший интерес представляют комбинированные антиоксиданты. Некоторые вещества обладают синергизмом, т.е. взаимно усиливают действия друг друга. Прием комбинации селена и витамина Е в течение как минимум 100 дней позволил улучшить морфологию и подвижность на 52,6% (362 случая из 690) и частоту спонтанной беременности на 10,8% (75 случаев) по сравнению с контрольной группой без терапии [53]. Результаты другого исследования свидетельствовали о значительном улучшении морфологии сперматозоидов в группах, получавших комбинацию L-аргинина и L-карнитина, ослабляя цитотоксический эффект противоопухолевого препарата бисульфана [54].
Удачным сочетанием компонентов с синергизмом является препарат АндроДоз (L-аргинин, L-карнитин, L-карнозин, коэнзим Q10, глицирризиновая кислота, цинк, витамин Е, витамин А, селен). В российском многоцентровом открытом исследовании через 3 мес от начала приема АндроДоза отмечено статистически значимое снижение на 26,32% количества аномальных форм сперматозоидов (р=0,0001) [55].
В другом российском исследовании применение АндроДоза пациентами с идиопатической патоспермией в течение 3 мес приводило к увеличению количества морфологически нормальных форм на 50%, а также объема эякулята на 45,7%, концентрации сперматозоидов на 18,5%, активной подвижности на 38,4% [56]. Еще одно исследование продемонстрировало увеличение содержания цинка семенной плазмы на 79,3% с достоверностью различий до и после месячного курса приема комплекса: с 0,92 до 1,65 ммоль/л (p<0,05) [57].
Практика назначения оральных антиоксидантов поддерживается отсутствием связанных серьезных побочных эффектов. В идеале пероральный антиоксидант должен достигать высоких концентраций в репродуктивном тракте и восполнять дефицит жизненно важных элементов для сперматогенеза. Антиоксидантная добавка должна усиливать антиоксидантную активность семенной плазмы и снижать уровень АФК. Тем не менее продукция АФК не должна быть полностью подавлена, так как это может приводить к нарушению нормальной функции сперматозоида (например, капацитации и гиперактивации), которые обычно требуют низких уровней присутствия свободных радикалов [58, 59].
Терапия лейкоспермии. На данный момент нет единого мнения о роли инфекции в формировании бесплодного брака. Антибиотикотерапия помимо элиминации возбудителя повышает антиоксидантную активность эякулята. Определение наличия лейкоцитов, особенно полиморфноядерных форм, является важным аспектом процедуры оценки морфологии сперматозоидов, так как они служат источником АФК [41, 48]. К планированию зачатия после антибиотикотерапии следует подходить с некоторой осторожностью. Фторхинолоны и аминогликозиды отрицательно влияют на ткань яичка и параметры спермы. В исследованиях наблюдают время- и дозозависимый отрицательный эффект ципрофлоксацина на морфологию сперматозоидов. Также изменяющими морфологию антибиотиками проявили себя энрофлоксацин, офлоксацин, стрептомицин, неомицин, гентамицин [60, 61]. Комбинированная терапия антибиотик+антиоксидант может сохранить целостность мембран сперматозоидов, ослаблив токсическое действие антибиотиков [61]. Стабилизаторы мембран тучных клеток (кетотифен) также способствовали снижению содержания лейкоцитов в эякуляте и закономерному увеличению доли морфологически нормальных форм сперматозоидов [62].
Гормональная терапия. Эмпирическая гормональная терапия (гонадотропины, антиэстрогены, ингибиторы ароматаз) при идиопатических формах изолированной тератозооспермии не показана [48, 64]. Тем не менее H. Tang и соавт. отметили: чем выше уровень сывороточного свободного и биодоступного тестостерона, тем выше процент морфологически нормальных сперматозоидов, что указывает на вероятное участие гормонов в патогенезе тератозооспермии [64]. Ряд исследований был посвящен оценке роли введения ФСГ в улучшении морфологии сперматозоидов и исходов ВРТ. Некоторые данные показывают, что гонадотропины способны улучшать ультраструктуру, увеличивать конденсацию ДНК сперматозоида и уменьшать спермапоптоз с последующим увеличением показателей оплодотворения. Однако никаких рекомендаций и стандартизированных протоколов не существует [65]. Европейская ассоциация урологов не рекомендует использовать гонадотропины для лечения идиопатического мужского бесплодия из-за отсутствия однозначной эффективности. Также не рекомендуется эмпирическое использование пульс-терапии гонадолиберином ввиду отсутствия результатов контролируемых исследований [48]. Вместе с тем несколько авторов продемонстрировали лучшие результаты для комбинированной терапии антиэстроген+антиоксидант в контролируемых исследованиях [66, 67].
Другие препараты. Улучшение параметров эякулята, в частности морфологии, наблюдали при приеме ингибиторов фосфодиэстеразы 5-го типа (иФДЭ-5) [68].
В российском исследовании Е.А. Ефремов и др. не обнаружили статистически значимого изменения морфологических форм при приеме силденафила, тадалафила и варденафила. По данным этого исследования [69], также и в группе варденафила отмечалось небольшое снижение индекса сперматогенеза. Повышение процента нормальных форм наблюдали на фоне применения неспецифического ингибитора фосфодиэстеразы (пентоксифиллин) [70].
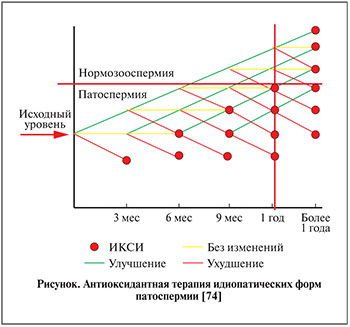
Идиопатическая форма изолированной тератозооспермии представляет собой сложную задачу для клинициста, поскольку многие предложенные методы терапии не обладают особой эффективностью и преимуществами. Гормональная терапия, антибактериальные и противовоспалительные и другие лекарственные средства были использованы в качестве монотерапии или в комбинации как в контролируемых, так и в неконтролируемых исследованиях, но их эффективность по-прежнему под вопросом. Антиоксиданты, по всей видимости, являются наиболее исследованным и безопасным методом эмпирической терапии. Собственные рекомендации. Основываясь на результатах рассмотренных исследований и собственном клиническом опыте применения антиоксидантов при патоспермии [71–73], предлагаем следущую схему медикаментозной терапии пациентов с идиопатической формой изолированной тератозооспермии (см. рисунок). При улучшении морфологии относительно исходной точки целесообразно продолжить терапию антиоксидантами до следующего контрольного обследования. По достижении нормозооспермии рекомендуется продолжить курсовой прием антиоксидантов. При ухудшении по результатам обследования либо по истечении одного года наблюдения решается вопрос об ИКСИ. В случае когда динамика отсутствует, целесообразно обсудить с пациентом возможность еще одного курса антиоксидантов.
Поскольку цикл развития сперматозоида составляет 72–76 дней, обследование целесообразно проводить в период, кратный 3 месяцам в течение одного года или менее. Принимая во внимание доказанное превентивное действие антиоксидантов в вопросах невынашивания беременности и нарушениях раннего эмбриогенеза [75], мы не рекомендуем пациентам прерывать естественное планирование даже при выраженной тератозооспермии (0%). Так, некоторые пары с отсутствием нормальных форм сперматозоидов по строгим критериям могут надеяться на достижение естественной беременности при терапии антиоксидантами или по крайней мере с учетом всего вышеизложенного улучшить исходы методов ВРТ [76]. Принимая во внимание возможный риск сниженной частоты оплодотворения при ЭКО, отдаем предпочтение методу ИКСИ, несмотря на то что уровни достижения беременностей между двумя методами существенно не различаются [24–27].
Данная схема антиоксидантной терапии может быть применима к другим формам патоспермии в отсутствие выраженного женского фактора и генетически обусловленного мужского бесплодия, а также в комбинации с другими этиотропными методами терапии мужского бесплодия. По факту достижения нормозооспермии можно обсуждать с парой естественное планирование еще в течение года. С парами, которые в отсутствие положительной динамики решили продолжить эмпирическое лечение антиоксидантами или другими медикаментозными средствами, следует проводить беседу о влиянии возраста женщины на неблагоприятные исходы и снижение эффективности результатов ВРТ [22].


