Актуальность. Согласно определению Между-народного общества по проблемам, связанным с недержанием мочи (International Continence Society, ICS), синдром гиперактивного мочевого пузыря (ГМП) – это симптомокомплекс, сопровождающийся ургентностью и ноктурией с недержанием мочи или без такового и учащенным мочеиспусканием при доказанном отсутствии инфекции мочевыводящих путей (МВП) или другой очевидной патологии нижнего отдела МВП [1–3]. По данным ICS, от 50 до 100 млн человек в мире страдают ГМП. В РФ заболеваемость ГМП в формах статистического наблюдения не регистрируют. По данным отдельных авторов, случаи ГМП в 1995–2000 гг. составили 16–19% от всех заболеваний нижних МВП [4].
Основной целью фармакотерапии ГМП является подавление сокращения мочевого пузыря в фазу наполнения, снижение афферентной импульсации и увеличение емкости мочевого пузыря [5–9]. Мирабегрон – селективный агонист β3-адренорецепторов, который улучшает резервуарную функцию мочевого пузыря за счет стимуляции β3-адренорецепторов, расположенных в его стенке [10–16]. Часть исследователей видят в мирабегроне альтернативу антихолинергическим препаратам в случае их неэффективности или плохой переносимости [16–20]. В зарубежных клинико-экономических исследованиях показана эффективность мирабегрона в терапии ГМП [21–24].
Цель работы: оценить фармакоэкономическую целесообразность применения мирабегрона для терапии ГМП с позиций государственной системы здравоохранения и пациента в условиях РФ.
Материалы и методы. При разработке модели для клинико-экономического анализа были использованы отраслевые стандарты Клинико-экономического исследования, применяемые в РФ и рекомендуемые экспертами [25–28]. В ходе собственно фармакоэкономического анализа был проведен анализ эффективности затрат (cost-effectiveness analysis – CEA) с расчетом показателя коэффициента эффективности затрат (cost-effectiveness ratio – CER). Дополнительно был выполнен анализ «влияния на бюджет» с годичной и трехлетней перспективой [29]. В рамках анализа влияния на бюджет были также проанализированы экономическая эффективность и доступность технологии [30].
Затраты. Был составлен перечень прямых затрат (ПЗ): стоимость лечения основного заболевания (ГМП) – затраты на лекарственные средства (ЛС) первой и второй линий; стоимость лечения, направленного на коррекцию нежелательных явлений (НЯ), вызванных применением ЛС для лечения основного заболевания; стоимость лабораторных и инструментальных методов исследований, а также госпитализации и амбулаторного лечения; стоимость лечения в случае неэффективности терапии ЛС первой и второй линий; стоимость лечения пациентов в случае отсутствия приверженности к терапии препаратами оцениваемых стратегий. Кроме того, был составлен перечень непрямых затрат (НЗ): недополученный доход пациента в связи с временной нетрудоспособностью; затраты фонда социального страхования на выплату пособия по временной нетрудоспособности; определение недополученной выгоды в виде валового регионального продукта (ВРП). Затраты на лечение были оценены на основании данных «Медлюкс – наличие ЛС в аптеках Москвы» [31], Государственного реестра предельных отпускных цен [32], на основании Постановления Правительства РФ № 1273 «О программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2015 год и на плановый период 2016 и 2017 годов» от 28.11.2014 [33], Генерального тарифного соглашения на 2015 г. (ГТС) [34] и других источников.
Эффективность лечения. Критерии эффективности сформированы на основе действенности (efficacy), которая оценивалась в рамках результатов рандомизированных клинических исследований (РКИ) и мета-анализов. Основываясь на клинических исследованиях применения указанных медицинских технологий лечения ГМП, критериями эффективности терапии были изменение среднего количества эпизодов недержания в течение суток относительно исходного уровня; изменение среднего количества мочеиспусканий в течение суток; изменение среднего количества эпизодов императивного позыва к мочеиспусканию в течение суток; снижение числа эпизодов недержания более чем на 50 %/удовлетворенность терапией; отсутствие эпизодов недержания в течение суток; QALYs (quality adjusted life of years – количество добавленных лет жизни с поправкой на качество); комплаентность.
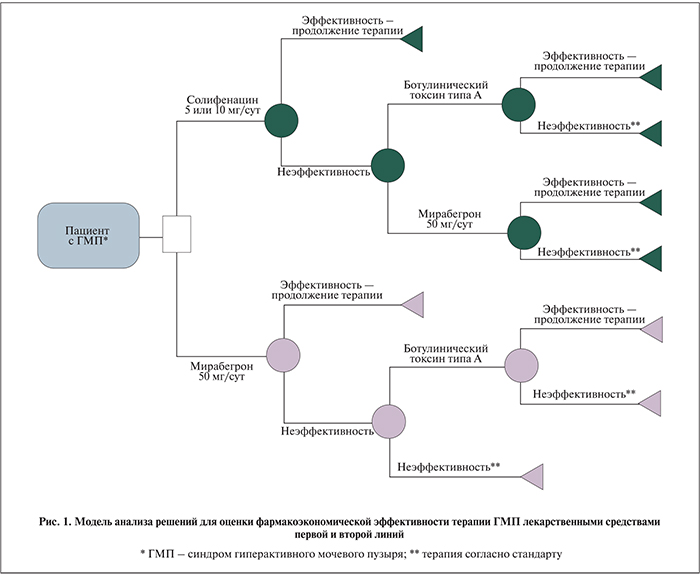
Структура модели. Для клинико-экономической оценки ЛС в лечении ГМП была использована «модель анализа решений». В основу модели положены крупные РКИ [35–37], с помощью которых определены демографические показатели оцениваемой когорты пациентов и соотношение между стратегиями оказания медицинской помощи. Фармакоэкономическая модель анализа решений была построена таким образом, что в каждой из ветвей модели проанализированы затраты и эффективность в группе из 100 пациентов. Затем для каждой из групп рассчитана стоимость лечения 1 пациента.
Модель начинали с выбора ЛС для терапии первой линии ГМП: мирабегрон 50 мг/сут, солифенацин 5 мг/сут, солифенацин 10 мг/сут [32] (рис. 1). Терапию считали эффективной, если у пациента отмечалось снижение числа эпизодов недержания более чем на 50%/удовлетворенность терапией. Длительность моделирования для стратегий первой линии – 3 мес. В случае неэффективности терапии пациент получал медицинскую помощь в объеме, предусмотренном стандартом [38], которая включает консультативно-диагностические, реабилитационно-восстановительные и лечебные мероприятия, а также назначали терапию второй линии. После стратегии с использованием мирабегрона применяли ботулинический токсин типа А, после стратегии с применением солифенацина – мирабегрон или ботулинический токсин типа А. Дополнительно в ходе моделирования учитывали данные о комплаентности пациентов к терапии ЛС оцениваемых стратегий [39]. Так, в случае отсутствия приверженности терапию также считали неэффективной. Эффективность лечения ГМП каждой из стратегий второй линии оценивали в соответствии с перечисленными критериями эффективности [41–45]. Длительность моделирования для стратегий второй линии – 3 мес (см. рис. 1).
Дополнительно оценивали вероятность развития тех или иных НЯ оцениваемых стратегий терапии с учетом стоимости оказания медицинской помощи, направленной на их коррекцию.
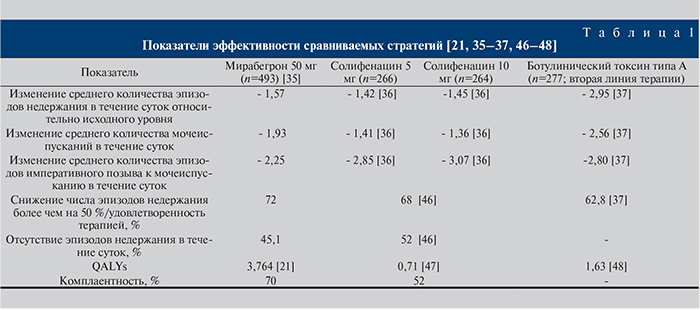
Источники данных для математического моделирования. В табл. 1 суммированы показатели эффективности терапии первой и второй линий для пациентов с ГМП.
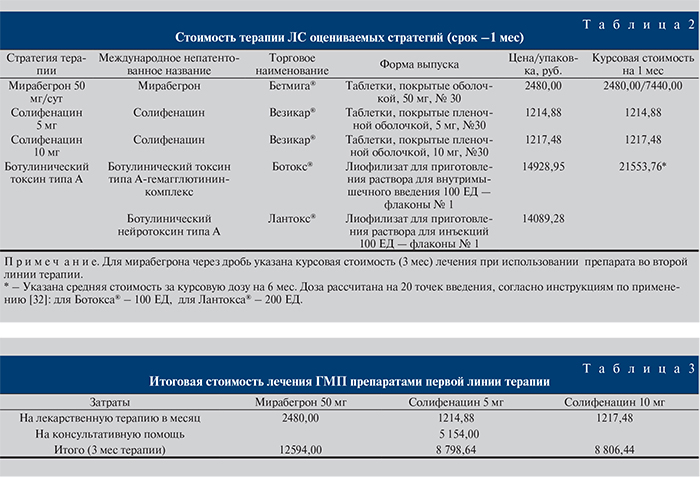
В основе расчетов – данные из нормативов финансовых затрат на единицу объема медицинской помощи (табл. 2) [33, 34].
Итоговая стоимость оказания медицинской помощи больным ГМП по каждой из стратегий указана в табл. 3 из расчета на 1 мес и в соответствии с горизонтом моделирования первой линии терапии – 3 мес.
Стоимость стратегий оказания медицинской помощи больным ГМП при применении второй линии терапии вследствие неэффективности первой проводилась из расчета на 3 мес и в соответствии с горизонтом моделирования второй линии терапии 3 мес, составила для мирабегрона и ботулинического токсина А 22466,97 и 40901,64 руб. соответственно [38]. В случае неэффективности какой-либо из оцениваемых стратегий первой и второй линий терапии ГМП допускали, что дополнительно пациент получал медицинскую помощь согласно рассмотренному стандарту из расчета для стратегий первой линии терапии 3 мес (15 026,97 руб.), для стратегий второй линии – 6 мес (30 053,93 руб.) [40–45], а также вынужден дополнительно использовать средства личной гигиены, предназначенные для пациентов с недержанием мочи. Дополнительно оценивали и НЗ [49–51]. Стоимость оказания медицинской помощи в случае отсутствия приверженности к терапии препаратами оцениваемых стратегий приравнивали к стоимости неэффективной терапии ввиду того, что предполагалось, что в случае отсутствия комплаенса к назначенной терапии у пациента сохраняются симптомы основного заболевания (соответствует состоянию модели в рамках затрат неэффективности терапии) [39–45]. Стоимость терапии, направленной на коррекцию НЯ, возникающих на фоне применения ЛС первой и второй линий терапии ГМП, складывали из стоимости амбулаторных визитов и госпитализаций в связи с развитием НЯ [34, 35, 37, 52].
Результаты. В основном сценарии была оценена стоимость каждой стратегии лечения пациента целевой группы (ПЗ и НЗ). Для всех стратегий сравнения временной горизонт моделирования составил 12 мес. Также стратегии мирабегрона и ботулинического токсина типа А были оценены отдельно по результатам моделирования второй линии терапии.
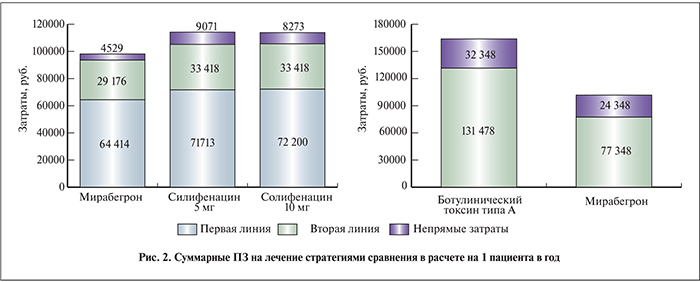
Как видно из представленных на рис. 2 данных, при горизонте моделирования 1 год наибольшие ПЗ имели место при применении стратегии солифенацина в дозе 5 мг/сут — 114 202 руб. Суммарные затраты при использовании солифенацина в дозе 10 мг/сут были на 2% меньше и составили 113 892 руб. в расчете на 1 пациента. Наименьшими затратами характеризовалась стратегия мирабегрона – 98 119 руб. В группе лечения мигабегрона НЗ составили 4529 руб. в расчете на 1 пациента, что ниже соответствующих затрат в группе солифенацина в дозе 5 и 10 мг/сут. Также следует отметить меньшие затраты на собственно терапию в группе мирабегрона – 93 590 руб., что на 12% ниже аналогичных затрат при использовании стратегии солифенацина (105 131 и 105 618 руб. для солифенацина в дозах 5 и 10 мг/сут соответственно).
При сравнении стратегий мирабегрона и ботулинического токсина типа А в качестве препаратов второй линии терапии ГМП наибольшими затратами характеризовалась последняя – 163 826 руб. При этом наибольшая разница возникала вследствие различной стоимости курса ЛС (58 373 и 18 154 руб. соответственно в группе ботулинического токсина типа А и мирабегрона), а также затрат, связанных с возникающими НЯ (11 843 и 1971 руб. соответственно).
При рассмотрении стратегий в целом основными составляющими ПЗ терапии были расходы на консультации и дополнительные затраты (доля затрат от 62 до 68 %). Собственно на ЛС приходилось от 22 (стратегия солифенацина) до 34% (стратегия мирабегрона) затрат на терапию. При этом в случае стратегии солифенацина в дозе 5 мг/сут доля затрат на коррекцию НЯ составила 11 %, в то время как в группе мирабегрона – лишь 4 %.
При выделении отдельно затрат на вторую линию терапии процентные соотношения составляющих ПЗ на терапию в группах рассматриваемых ЛС мирабегрона и ботулинического токсина типа А значительно различались. Так, доля затрат на ЛС в стратегии применения ботулинического токсина типа А составила 44%, а при использовании мирабегрона – 23%. Следует также отметить, что в случае применения ботулинического токсина типа А 9% от затрат на терапию приходилось на коррекцию НЯ, в то время как соответствующий показатель в группе мирабегрона был равен 3%.
При оценке частоты возникновения различных НЯ в группах сравнения установлено, что такие осложнения, как диарея, сухость во рту, запор, неясное зрение, чаще возникали в группе солифенацина 10 мг/сут. Кроме того, при использовании солифенацина чаще возникали фибрилляции предсердий и иные неотложные состояния – 4,8 против 0,4% у мирабегрона. Также в данной группе по сравнению с мирабегроном чаще регистрировали диарею, рвоту и инфекции МВП. Частота возникновения последней в стратегии солифенацина составила 6,2 против 1,4% в группе мирабегрона, в группе ботулинического токсина типа А второй линии терапии этот показатель был еще выше – 20,4%.
Стратегия применения мирабегрона характеризовалась наибольшей эффективностью по сравнению с другими стратегиями: соответствующий показатель удовлетворенности терапией составил 72%, тогда как для солифенацина (в обеих дозировках) – 68%. При оценке показателя QALYs стратегия мирабегрона также показала лучший результат – 3,76, что выше соответствующего показателя для солифенацина (0,71) более чем в 5 раз. Кроме того, приверженность к терапии при использовании мирабегрона также оказалась выше, чем при назначении солифенацина, – 70 против 52%. При сравнении с препаратами ботулинического токсина (вторая линия терапии) мирабегрон оказался более эффективным: удовлетворенность терапией отмечена в 72% случаев (против 63% при использовании ботулинического токсина типа А), а показатель QALYs у стратегии мирабегрона был выше соответствующего показателя для ботулинического токсина типа А в 2,3 раза (3,76 против 1,63).
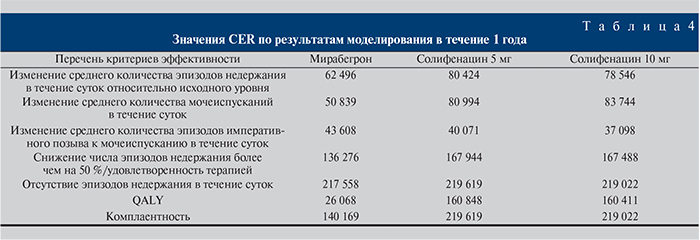
Коэффициенты эффективности затрат, характеризующие эффективность суммарных общих затрат на терапию 1 пациента для стратегий мирабегрона, солифенацина в дозах 5 и 10 мг/сут, представлены в табл. 4.
При рассмотрении таких критериев эффективности, как изменение среднего количества эпизодов недержания в течение суток относительно исходного уровня, изменение среднего количества мочеиспусканий в течение суток, снижение числа эпизодов недержания более чем на 50 %, QALYs и комплаентность, наименьший показатель CER был получен для стратегии мирабегрона. Таким образом, применительно к данным критериям эффективности использование мирабегрона экономически целесообразно с точки зрения соотношения стоимости и эффективности при сравнении со стратегиями солифенацина в разных дозировках. Применение мирабегрона при ГМП в первой линии терапии – экономически выгодная медицинская технология. При рассмотрении отдельно второй линии терапии коэффициенты CER для стратегий мирабегрона и ботулинического токсина типа А составили по возрастающей – 141 295 и 260 869 руб. соответственно.
Анализ чувствительности. Вероятностный анализ чувствительности выполняли, многократно изменяя входные параметры модели таких показателей, как эффективность, а также стоимость ЛС. В результате при одновременном многократном изменении таких параметров, как эффективность и стоимость ЛС, стратегия применения мирабегрона оставалась наиболее эффективной, стратегия солифенацина – наиболее затратной. Анализ чувствительности подтвердил результаты, полученные в основном сценарии. При этом следует отметить, что наиболее чувствительные результаты были к стоимости ЛС.
Анализ влияния на бюджет. В расчет входили ПЗ, связанные с применением стратегий сравнения, а также НЗ. При расчете учитывали эффективность каждой из стратегий. Разница в суммарных ПЗ определена как экономия при применении той или иной стратегии. Также было рассчитано число пациентов, на которых можно было потратить сэкономленные средства. Затраты на 1 пациента при применении мирабегрона составили 98 119 руб., солифенацина в дозе 5 мг/сут – 114 202, солифенацина в дозе 10 мг/сут – 113 892 руб. Был также рассмотрен вариант только второй линии терапии. В этом случае затраты на 1 пациента при использовании стратегии мирабегрона составили 101 732 руб., ботулинического токсина типа А – 163 82. В результате при сравнении со стратегией солифенацина в дозах как 5, так и 10 мг/сут использование мирабегрона является более предпочтительной стратегией с точки зрения анализа «влияние на бюджет»: использование стратегии с применением мирабегрона позволяет сохранять значительные средства бюджета – до 16 083 327 руб, при этом сэкономленные средства позволяют пролечить данной стратегией дополнительно значительное количество пациентов – до 164. При рассмотрении отдельно второй линии терапии использование мирабегрона также является более предпочтительной стратегией с точки зрения анализа «влияние на бюджет», позволяя сохранять значительные средства бюджета – до 62 093 577 руб. При этом сэкономленные средства позволяют пролечить данной стратегией дополнительно значительное количество пациентов – до 610.
Обсуждение. Впервые в российских условиях был проведен сравнительный фармакоэкономический анализ применения препарата мирабегрон (Бетмига®) в терапии ГМП. По результатам моделирования было показано, что стратегия использования мирабегрона обладала наименьшими затратами, как прямыми, так и непрямыми, по сравнению с применением солифенацина в первой линии терапии ГМП; данная тенденция сохраняется и при сравнении со стратегией лечения во второй линии данного патологического состояния препаратами ботулинического токсина типа А. С учетом данных относительно большей эффективности мирабегрона по сравнению с другими стратегиями сравнения первой и второй линий терапии ГМП можно сделать вывод, согласно которому применение указанного препарата экономически целесообразно с точки зрения соотношения стоимости и эффективности. С точки зрения анализа «влияние на бюджет» при сравнении со стратегиями как первой (солифенацин в дозе 5 и 10 мг/сут), так и второй (ботулинический токсин типа А) линии терапии использование мирабегрона предпочтительно, так как позволяет сохранять значительные средства бюджета, а на сэкономленные средства, применяя ту же стратегию, можно дополнительно пролечить значительное количество пациентов.
Отечественных исследований по оценке фармакоэкономической целесообразности мирабегрона при ГМП ранее не проводилось, соответственно, сопоставить наши результаты с таковыми других авторов не можем. Из всех препаратов, применяемых при ГМП, клинико-экономический анализ был ранее проведен только для солифенацина в рамках сравнения групп пациентов, получавших лекарственную терапию по поводу данной патологии и пациентами без лечения. Авторы выбрали такой способ сравнения ввиду отсутствия какого-либо другого препарата в списке ЖВНЛП, а также вследствие того, что отсутствие лекарственного лечения ГМП остается распространенной практикой в РФ. В построенной модели авторами было показано, что затраты на солифенацин частично компенсируются снижением прямых медицинских затрат на ведение пациента с ГМП и полностью компенсируется снижением НПЗ [45]. Анализа «влияния на бюджет» проведено не было.
В зарубежных исследованиях проведена фармакоэкономическая оценка применения мирабегрона по сравнению с толтеродином гидротартратом, а также в рамках терапии второй линии с препаратами ботулинического токсином типа А [22–24], где мирабегрон продемонстрировал клинико-экономическую целесообразность его применения, однако дизайн исследования достаточно рознится с проведенным нами моделированием, также не был дополнительно проведен анализ «влияние на бюджет», отражающий экономическую предпочтительность использования той или иной медицинской технологии.
Выводы
1. Применение мирабегрона в качестве терапии первой и второй линий ГМП экономически целесообразно с точки зрения соотношения стоимости и эффективности.
2. Для данной стратегии характерны высокая клиническая эффективность и лучший профиль безопасности при наименьших затратах на купирование возникающих НЯ среди применяемых для лечения пациентов с ГМП медицинских технологий.
3. Использование мирабегрона по сравнению с солифенацином – более предпочтительная стратегия с точки зрения анализа «влияние на бюджет», так как позволяет сохранять значительные средства бюджета – до 16 083 327 руб., а также дополнительно пролечить до 164 пациентов.
4. Использование мирабегрона по сравнению со стратегией препаратов ботулинического токсина типа А во второй линии терапии ГМП предпочтительно с точки зрения анализа «влияние на бюджет»: экономия средств бюджета достигает 62 093 577 руб., что позволяет дополнительно пролечить до 610 пациентов.
5. Анализ экономической эффективности и доступности технологии, позволяющий оценить целесообразность внедрения той или иной технологии при наличии бюджетных ограничений, показал, что стратегия использования мирабегрона абсолютно доступна, при этом рост эффективности относительно стратегии солифенацина сопровождается снижением затрат и как следствие – снижением нагрузки на бюджет.
Ограничения исследования
Проведенный фармакоэкономический анализ имеет следующие особенности, относящиеся к параметрам ограничения исследования: данные по эффективности и безопасности, используемые для построения модели, получены в условиях РКИ, что отличается от условий реальной практики; в расчете прямых затрат на оказание помощи по той или иной нозологии учитывали стандарты терапии, зарегистрированные в РФ, при этом описание популяции и показатели эффективности взяты из зарубежных исследований.


