Введение. В настоящее время лапароскопическая парциальная нефрэктомия (ЛПН) является эффективным и малоинвазивным методом оперативного лечения больных локализованным раком почки [1–4]. Данная операция обладает всеми преимуществами минимально инвазивной хирургии и за последнее десятилетие стала альтернативой открытой резекции почки [5, 6]. При этом функциональные и онкологические результаты открытой и лапароскопической парциальной нефрэктомии отличаются незначительно [4, 5–7]. В литературе много публикаций, освещающих различные аспекты ЛПН, но большинство из них касается оценки эффективности лечения периферических, эндофитных или синусных опухолей почки [8–11]. Образования «неудобной» локализации изначально считались относительным противопоказанием к ЛПН [8, 9]. К ним обычно относятся эндофитные синусные опухоли, расположенные глубоко и близко к почечным сосудам или к их крупным ветвям [8, 9, 11]. При локализации образований на противоположной от хирургического доступа поверхности почки уролог сталкивается с определенными трудностями при резекции и проведении гемостаза. Так, трансперитонеальная ЛПН у больных с дорзально расположенными опухолями верхнего полюса почки может осложняться длительным временем операции и тепловой ишемии, а также большим объемом кровопотери. В целом определенные трудности и высокий инцидент возможных осложнений могут стать причиной конверсии [12]. При подобном расположении опухоли почки ротация ее вокруг сосудистой ножки может сделать локализацию образования более удобной для резекции и снизить опасность развития различных осложнений.
Цель. Представить технику и результаты ЛПН при опухолях верхнего полюса почки с ее ротацией вокруг сосудистой ножки.
Материалы и методы. В клинике урологии СЗГМУ им. Мечникова ЛПН выполнена 125 больным. Ретроспективно проанализированы результаты лечения 12 больных опухолями верхнего полюса, которым была проведена резекция почки с использованием методики ротации ее вокруг сосудистой ножки. Мужчин среди них было 8 (66,7%), женщин – 4 (33,3%), средний возраст составил 52,6±11,3 (46–68 лет) года, индекс массы тела – 28,4±1,6 (24,7–32,8) кг/м2.
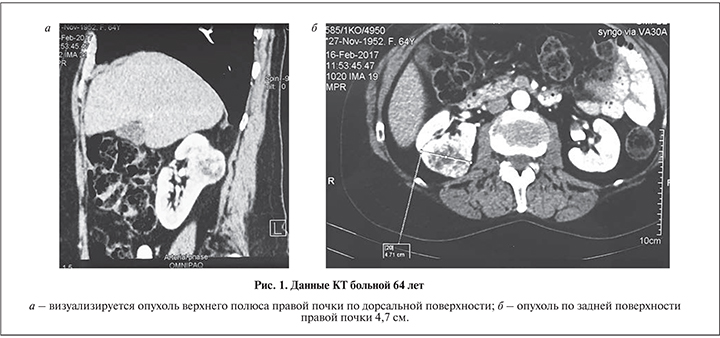
Всем больным выполнены лабораторные исследования (включая определение уровня гемоглобина и креатинина до и после операции), МСКТ с внутривенным контрастированием и ангиографией, динамическая сцинтиграфия. Опухоль верхнего полюса правой почки диагностирована у 7 (58,3%) пациентов, левой – у 5 (41,7%). Случаев с опухолью единственной почки не было. Размеры опухоли колебались от 2,5 до 4,8 см. У всех пациентов опухоль верхнего полюса почки определена по ее дорсальной поверхности.
С целью определения характеристики опухоли, включая ее размер, локализацию и сложность, использовали систему RENAL (радиус, экзофитная/эндофитная, близость к полостной системе в мм, передняя/задняя локализация, отношение к полар [к поперечным линиям, проведенным через края почечного синуса] линиям). У 5 больных оценка соответствовала 4 баллам, у 3 – 5, у 2 – 6, у 1 – 7 и еще у 1 –10.
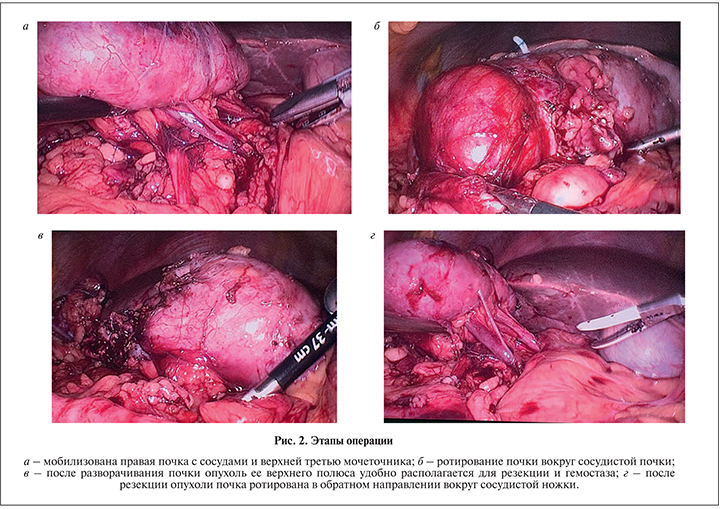
Техника операции. Больного укладывали в положение латеропозиции, устанавливали первый троакар 11 мм для лапароскопа в подвздошной области. После инсуфляции брюшной полости до 12 мм рт.ст. под визуальным контролем проводили два троакара по 11 мм медиальнее пупка и ниже реберной дуги под подключичной линии. Дополнительный троакар 6 мм для ассистента устанавливали по передней аксиллярной линии над гребнем подвздошной кости. При расположении опухоли в верхнем полюсе почки по дорзальной поверхности ее выделение, адекватная резекция образования, в особенности эндофитного, представляются сложными (рис. 1 а, б). Поэтому после установки троакаров мы выделили всю почки от паранефральной клетчатки, мобилизовали ее сосуды и верхнюю треть мочеточника (рис. 2, а).
Затем аккуратно ротировали почку вокруг сосудистой ножки под таким углом, чтобы достичь лучшей экспозиции опухоли для облегчения ее дальнейшей резекции (рис. 2, б). До удаления новообразования на ветвь почечной артерии, идущей к верхнему полюсу, накладывали резиновый турникет, натягивали его и устанавливали клипсу геми-лок. Затем иссекали опухоль с использованием лапароскопических ножниц на расстоянии 2–3 мм от края опухоли. В большинстве случаев пережатие артерии обеспечивало бескровное операционное поле и хорошую визуализацию границы между опухолью и паренхимой. При глубокой инцизии опухоли и вскрытии полостной системы непрерывным швом закрывали образовавшийся дефект (2 больных). Затем рассасывающейся нитью 2/0 на дефект паренхимы накладывали узловые швы, после натягивания устанавливали клипсу геми-лок (рис. 2, в). В отсутствие кровотечения из зоны резекции восстанавливали первоначальное положение почки путем ее реротации вокруг ножки в обратном направлении (рис. 2, г). Все пациенты были оперированы без установки мочеточникового стента.
В послеоперационном периоде проведен анализ таких параметров, как время операции и тепловой ишемии, объем кровопотери, сроки госпитализации и реабилитации больных. Удаленную опухоль отправляли на патогистологическое исследование для верификации ее гистологической структуры, стадии ТNМ и состояния края резекции. Кроме того, у всех прооперированных оценивали ранние онкологические результаты, местный рецидив и отдаленные метастазы.
Проводили статистический анализ демографических данных пациентов, интра- и послеоперационных результатов операций. Для оценки достоверности сравниваемых параметров использовали критерий Стьюдента для параметрических и Манна–Уитни для непараметрических данных.
Результаты. У всех 12 пациентов ЛПН прошла успешно. Случаев конверсии в открытую парциальную или радикальную нефрэктомию не было. Продолжительность операции колебалась от 90 до 210 мин (среднее 120±35,0 мин), время тепловой ишемии – от 10 до 26 мин (среднее 14,5±7,8 мин). Средний уровень креатинина до операции составил 75±10,5 мкмоль/л, после операции – 80±18 мкмоль/л (р>0,05). Случаев развития острой почечной недостаточности, требующей проведения гемодиализа, не было. Средний объем кровопотери составил 120,0±65,5 мл. Уровень гемоглобина до операции был равен 132,0±10,5 г/л, после операции – 114,0±8,6 г/л (р>0,05). Никто из пациентов не нуждался в гемотрансфузии ни во время, ни после операции. Срок госпитализации составил 5,0±1,6 (3–8) дня.
Интраоперационное осложнение имело место у 1 (8,3%) пациента. При мобилизации левой почки была травма селезенки. Произведена коагуляция кровоточащих сосудов и наложена гемостатическая губка Surgicel. В послеоперационном периоде наблюдалось 3 (25%) осложнения: лихорадка – у 2 (16,7%), послеоперационный парез кишечника – у 1 (7,1%). Кровотечения, периренального затека и подтекания мочи по дренажу не было.
Интра- и послеоперационные результаты показаны в таблице. Во всех наблюдениях имел место негативный край опухоли, заболевание соответствовало стадии Т1а в 10 (83,3%) случаях, Т1b – в 2 (16,7%). Патогистологическое исследование в 11 (91,7%) случаях выявило почечно-клеточный рак почки, в 1 (8,3%) – ангиомиолипому. При среднем периоде наблюдения 18,6±5,0 (6–28) мес. случаев местного рецидива и отдаленных метастазов зафиксировано не было.

Обсуждение. Широкое использование современных диагностических технологий привело к увеличению числа инцидентальных опухолей почки [1, 3, 4]. В большинстве случаев выявляются небольшие (Т1) новообразования, при которых методом хирургического лечения является ЛПН [3, 4]. Результаты сравнения ЛПН с открытой парциальной нефрэктомией показали, что она может быть безопасным и эффективным способом удаления небольших (<4 см) опухолей почки, показывая хорошие функциональные и онкологические результаты [4–7]. При ЛПН используются три основных доступа: трансперитонеальный, ретроперитонеальный и чресбрюшинный с ручным ассистированием. Каждый из них имеет свои преимущества и недостатки. Ретроперитонеальный доступ обеспечивает прямой непосредственный доступ к заднелатеральной поверхности почки и задним структурам ее синуса, требует меньшей диссекции в этой зоне, особенно при выделении ренальной артерии. При этом доступе отмечается низкий риск травмы органов брюшной полости и процент пареза кишечника, так как нет необходимости в его мобилизации [13]. Однако большинство урологов, занимающихся малоинвазивной хирургией заболеваний почек, менее знакомы с ним, чем со стандартным чресбрюшинным доступом. Кроме того, при опухолях, локализованных по передней поверхности почки, оптимален трансперитонеальный доступ, который обеспечивает достаточно большую рабочую полость и лучшую ориентацию в анатомических структурах.
Локализация опухоли наряду с ее размером значимо влияет на результаты выполнения ЛПН. Наиболее сложными являются образования почечного синуса и верхнего полюса. ЛПН при опухолях подобной локализации, в особенности по задней поверхности почки, может быть продолжительной по времени с длительной тепловой ишемией и повышенным объемом кровопотери.
Так, при анализе результатов ЛПН у 123 больных было установлено, что операции при опухолях верхнего полюса сопровождаются более высоким объемом кровопотери и процентом осложнений, чем образования другой локализации [14]. Изучение разницы в интра- и послеоперационных показателях при ЛПН опухолей верхнего и нижнего полюсов показало, что клинически значимо высокий процент гемотрансфузии наблюдался после резекции образования верхнего полюса (25 против 6%) [15]. Также было высоким количество интра- (17 против 4%) и послеоперационных (22 против 7%) осложнений, несмотря на отсутствие достоверной разницы между ними. Подобную же разницу в количестве осложнений (на 8% выше при ЛПН опухолей верхнего полюса) установили R. Narayanan и соавт. [16]. В работах [15, 16] был сделан вывод, согласно которому открытый доступ может быть предпочтительным для больных с новообразованиями данной локализации.
Эндофитные опухоли больших размеров, особенно локализованные в верхнем полюсе, могут лимитировать выполнение ЛПН. Ротация почки под возможным углом меняет положение опухоли на лучшее и удобное для резекции и ушивания, может решить проблемы, обсуждаемые выше. В исследовании [15], посвященном опухолям синуса почки, показано, что она может быть полностью мобилизована и ротирована для оптимальной визуализации новообразования. Это позволяет успешно производить резекцию опухоли и избегать нежелательных травм ренальных сосудов. Представленный опыт позволяет использовать метод ротации почки вокруг сосудистой ножки при ЛПН образований в ее верхнем полюсе по дорсальной поверхности. В зависимости от локализации опухоли направление и углы почечной ротации могут различаться. В соответствии с данными литературы и собственным опытом при трансперитонеальном доступе для прямой визуализации и адекватной резекции опухоли почки, расположенной в верхнем полюсе, необходим ее поворот приблизительно на 140–1800 [17, 18].
В нашей работе средний размер опухоли составил 3,6 (2,5–4,8) см, что было показанием к ЛПН. Изучение таких интраоперационных показателей, как время операции, время тепловой ишемии и объем кровопотери, показало, что результаты ЛПН с использованием метода ротации почечной ножки значимо не отличаются от таковых, регистрируемых при стандартной ЛПН. Незначительное снижение уровня гемоглобина после операции и отсутствие необходимости гемотрансфузии могут быть связанными с надежным контролем на этапе резекции опухоли верхнего полюса после поворота почки.
Все 12 оперированных нами пациентов имели негативный край резекции при окончательном морфологическом исследовании. Вместе с тем существуют некоторые ограничения к использованию данного метода при ЛПН. Это в основном связано с вариабельностью анатомии почечных сосудов. Как правило, они состоят из артерии и одной или двух вен, отходящих от абдоминальной аорты и нижней полой вены. При наличии нижнеполярной артерии или ветвей от подвздошных сосудов ротирование почки может приводить к их травме и кровотечению. В связи с этим на дооперационном этапе, используя МСКТ, необходимо исключить подобный вариант расположения сосудов.
Заключение. Опухоли верхнего полюса почки, расположенные по ее дорсальной поверхности, труднодоступные для резекции при трансперитонеальной ЛПН. Использование техники ротации почки вокруг ее сосудистой ножки позволяет с высокой эффективностью и минимальными осложнениями удалить новообразования подобной локализации.


