Введение. Лейкоплакия мочевого пузыря впервые описана Rokitansky в 1861 г. [1], но и до сих пор нет единомыслия ни в этиологии, ни в патогенезе этого заболевания [2]. А.Л. Шабад [3] считал лейкоплакию безусловно злокачественным заболеванием.
А.И. Неймарк и соавт. [4] усматривают прямую связь развития лейкоплакии мочевого пузыря с внутриклеточными инфекциями, передаваемыми половым путем.
А. Kasianandan и соавт. [5] рекомендуют выжидательную тактику. A. Højgaard и соавт. [2] настаивают на патоморфологической верификации диагноза и также считают допустимым выжидательное наблюдение. Исследователи [6, 7] в течение длительного времени наблюдали 20 женщин с лейкоплакией мочевого пузыря и у двух из них выявили карциному через 15 и 20 лет после впервые установленного диагноза «лейкоплакия». Однако авторы не уверены в прямой причинно-следственной связи.
M. DeKock и соавт. [8] также связывали развитие рака мочевого пузыря с предшествующей лейкоплакией. J. Lozano Ortega и соавт. [9] выявили случай тотальной кератинизирующей десквамативной сквамозной метаплазии мочевого пузыря, но сомневались: можно ли отнести его к истинной лейкоплакии, поскольку в моче больных были обнаружены атипичные клетки? Вероятнее всего, имела место диагностическая ошибка, что подтверждает и работа [10]. Авторы оценивали неопластический риск при лейкоплакии по мутации гена ТР53 и установили отрицательную корреляцию. Сделан вывод, что, во-первых, истинная лейкоплакия в отличие от опухоли не выходит за пределы мочепузырного треугольника, а во-вторых, нет оснований рассматривать лейкоплакию как безусловную предпосылку к развитию рака мочевого пузыря.
A. Ganeshappa и соавт. [11] интерпретировали кератинизирующую десквамативную сквамозную метаплазию мочевого пузыря также как холестеатому (синоним лейкоплакии). Однако и они сомневались, что такое изменение структуры стенки мочевого пузыря способствует злокачественному перерождению тканей, хотя и не исключали сопутствующего развития опухоли.
К сожалению, основные вопросы – обязательна ли патоморфологическая верификация диагноза? Нужно ли лечить больного лейкоплакией? Можно ли ограничиться выжидательным наблюдением, эффективна ли консервативная терапия, или необходимо срочное хирургическое вмешательство? Насколько радикальным должно быть оперативное пособие? Насколько высок риск озлокачествления лейкоплакии? Есть ли смысл в инстилляциях? – до сих пор остаются без однозначного ответа. Ни в России, ни за рубежом нет четко регламентированных подходов к диагностике и лечению этого заболевания. Отсутствие четкого руководства приводит к неоправданному назначению таким пациентам различных медикаментозных препаратов, например α-адреноблокаторов, инстилляций целого ряда препаратов – как одиночно, так и в виде коктейля. Велика тенденция к активному хирургическому вмешательству – во многих клиниках проводят трансуретральную резекцию (ТУР) всем больным с лейкоплакией мочевого пузыря. Несмотря на немалое количество работ, так или иначе затрагивающих эту проблему, полной ясности до сих пор нет.
 Мы поставили цель выяснить, насколько целесообразна ТУР при лейкоплакии мочевого пузыря, и определить эффективность альтернативной малоинвазивной методики – лазерной коагуляции патологически измененной слизистой.
Мы поставили цель выяснить, насколько целесообразна ТУР при лейкоплакии мочевого пузыря, и определить эффективность альтернативной малоинвазивной методики – лазерной коагуляции патологически измененной слизистой.
Материалы и методы. Ретроспективно проанализированы истории болезни 76 женщин, перенесших ТУР по поводу лейкоплакии мочевого пузыря, а также проведено полное клинико-лабораторное обследование их через год после выполнения операции. Обследование включало опрос, заполнение аналогово-визуальной шкалы по оценке боли (0 – нет боли, 10 баллов – нестерпимая боль), заполнение анкеты по оценке качества жизни (0 – невыносимо ужасно, 5 – великолепно); самооценке эффективности хирургического вмешательства по следующим градациям: «стало хуже, чем было», «без изменений», «незначительно лучше», «лучше», «значительно лучше», «наступило выздоровление». Выполняли общий анализ мочи, урофлоуметрию с определением максимальной и средней скорости потока мочи, цистоскопию с биопсией стенки мочевого пузыря.
Лазерная интерстициальная терапия (ЛИТ) была выполнена 32 больным после аналогичного обследования; диагноз у всех верифицировали патоморфологически.
Для процедуры использовали YAG-Nd лазер (иттрий-алюмо-гранатовый с неодимом) Medilas Fibertom 5100 («Dornier MedTech», Германия) – лазер постоянного излучения мощностью до 100 Вт с длиной волны 1064 нм. Данная универсальная система идеально подходит для широкого спектра хирургических процедур, включая бесконтактную или внутритканевую коагуляцию, бескровную вапоризацию и точное отсечение тканей. Лазер Medilas Fibertom 5100 обеспечивает также уникальные средства безопасности, включая систему защиты световода (LPS), и режим резания Fibertom.
Техника проведения ЛИТ (патент РФ на изобретение № 2289354). Процедуру осуществляли в условиях операционной под внутривенной или эпидуральной анестезией. Пациентку укладывали на операционный стол с поднятыми и согнутыми в коленях ногами; ноги фиксировали. Промежность дважды обрабатывали водным раствором хлоргексидина; уретру инстиллировали катеджелем. В мочевой пузырь вводили фиброцистоскоп. Через дренажную систему наполняли мочевой пузырь стерильным 0,9%-ным раствором натрия хлорида и выполняли смотровую цистоскопию, определяя зоны предполагаемого воздействия. Через цистоскоп подводили световод, прижимая его к стенке мочевого пузыря. Ножной педалью включали лазерный излучатель и продолжали воздействие до появления кратерообразной зоны коагуляции. Воздействие осуществляли в 5–8 точках. По завершении процедуры физиологический раствор выпускали, цистоскоп удаляли.
Проведение ЛИТ может вызывать незначительное усиление дизурии в первые сутки после ее выполнения, как правило не требующее дополнительных воздействий.
Через 1 год после ЛИТ все пациентки также подверглись полному контрольному обследованию.
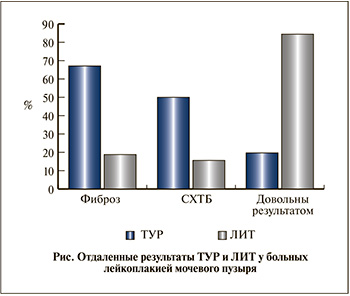
Результаты. Среди пациенток, подвергшихся ТУР, диагноз был верифицирован патоморфологически лишь у 54 (71%). Улучшение в ближайшем послеоперационном периоде отметили 69 (90,8%) пациенток, однако боль возобновилась через 3–6 мес у 61 (80,3%) больной. Через год после ТУР упорный некорригируемый синдром хронической тазовой боли (СХТБ) сформировался у 38 (50%) пациенток, фиброз мочепузырного треугольника диагностирован у 51 (67,1%) больной. При самооценке эффективности проведенного лечения 34 (44,7%) пациентки сообщили, что «стало хуже, чем было». В целом неудовлетворительные отдаленные результаты были получены от 61 (80,3%) больной.
Пациентки, подвергнутые ЛИТ, продемонстрировали значительно лучшие как ближайшие, так и отдаленные результаты. Через год после операции 27 (84,4%) пациенток не предъявляли никаких жалоб, столько же оказались довольными результатом. При контрольной цистоскопии констатирован полный регресс патологических образований слизистой мочевого пузыря. Патоморфологическое исследование биоптатов не выявило лейкоплакии; умеренный фиброз в зоне воздействия имел место у 6 (18,8%) пациенток; присутствовала умеренная лимфоцитарная инфильтрация, выявлялись гнезда Бруна.
Сопоставление отдаленных результатов лечения (см. рисунок) выявило несомненные преимущества малоинвазивного вмешательства – ЛИТ. Мультифокальное точечное воздействие YAG-Nd лазером (итрий-алюмо-гранатовый с неодимом) на стенку мочевого пузыря позволяет добиваться снижения ирритативной симптоматики, уменьшения частоты мочеиспусканий, уменьшения болевого синдрома за счет развития локального асептического воспаления с последующим усилением микроциркуляции, реваскуляризации в подслизистом слое, купированием гипоксии и восстановлением метаболического потенциала детрузора. В отличие от ТУР при ЛИТ кровопотеря практически отсутствует.
Показано преимущество ЛИТ: синдром хронической тазовой боли после этой операции сохранялся в 3 раза реже, чем после ТУР (15,6 и 50% соответственно), фиброз зоны воздействия формировался в 3,5 раза реже (18,8 и 67,1% соответственно). Только 19,7% пациенток, перенесших ТУР, через год оставались довольными результатом лечения, в то время как после ЛИТ таковых было 84,4%.
Обсуждение. Типичная локализация лейкоплакии – область мочепузырного треугольника. Наиболее часто используемая тактика ведения пациентов в Российской Федерации – местное лечение и трансуретральная резекция, эффективность которых не доказана.
Мочепузырный треугольник – особая область, имеющая ряд особенностей. Треугольник мочевого пузыря имеет общее происхождение с влагалищем и представляет собой эндокринно-рецепторный орган. С периода половой зрелости плоский эпителий треугольника Льето, подобно влагалищному, подвержен циклическим изменениям в течение менструального цикла соответственно гормональным сдвигам. В многослойном плоском эпителии треугольника Льето и влагалище происходит синтез гликогена, который является субстратом для молочной кислоты [12]. Постоянная циклическая десквамация и цитолиз поверхностных клеток плоского эпителия, ферментативное расщепление гликогена до глюкозы и молочной кислоты (концентрация последней поддерживает кислотность мочи) представляют собой один из механизмов защиты слизистой оболочки мочевого пузыря и влагалища.
Трансуретральная резекция слизистой в области шейки мочевого пузыря нарушает функцию эндокринно-рецепторного органа и один из механизмов защиты слизистой оболочки мочевого пузыря, может приводить к склерозированию шейки, в силу чего не является, на наш взгляд, оптимальным методом лечения больных лейкоплакией мочевого пузыря.
Выводы
1. Имеет место существенная гипердиагностика лейкоплакии мочевого пузыря и переоценка ее влияния на мочеиспускание. Обнаружение при цистоскопии белесых бляшек ни в коем случае не может трактоваться как «лейкоплакия» без гистологического подтверждения.
2. Лейкоплакия мочевого пузыря не является угрожающим для жизни состоянием и не должна рассматриваться как показание к срочному хирургическому вмешательству.
3. Трансуретральная резекция не является оптимальным методом лечения больных лейкоплакией мочевого пузыря.
4. Малоинвазивная лазерная интерстициальная терапия при помощи лазера Medilas Fibertom 5100 («Dornier MedTech», Германия) – безопасный, высокоэффективный, легковыполнимый способ лечения больных лейкоплакией мочевого пузыря, позволяющий получать хорошие отдаленные результаты.


