Введение. Почечно-клеточный рак (ПКР) – это наиболее часто встречающийся вид злокачественного новообразования почки; на его долю приходится 90–95% от всех опухолей почек и около 4% от числа всех эпителиальных новообразований [1–3]. В течение последних двух десятилетий ежегодный прирост частоты ПКР составил 2% как в Европе, так и во всем мире (данные Всемирной организации здравоохранения за 2013 г.) [2, 4].
 Общемировая заболеваемость ПКР в 2012 г. составила около 338 тыс. случаев, при этом смертность превысила отметку в 144 тыс. [1]. В России, по данным Российского центра информационных технологий и эпидемиологических исследований в области онкологии за 2015 г., ПКР был выявлен у 22 846 человек, что составило 3,9% от всех впервые выявленных опухолей различных локализаций, при этом смертность составила 8511 случаев. В течение 1 года число зарегистрированных в России новых случаев ПКР выросло почти на 5% [5]. Рост числа впервые выявленных новообразований во многом обусловлен улучшением диагностики за счет более широкого использования в клинической практике современных лучевых методов визуализации: УЗИ, МСКТ и МРТ. Благодаря этим методам стало возможным раннее выявление небольших опухолей (стадия T1) [3], как правило, протекающих бессимптомно (более чем у половины заболевших) [6, 7].
Общемировая заболеваемость ПКР в 2012 г. составила около 338 тыс. случаев, при этом смертность превысила отметку в 144 тыс. [1]. В России, по данным Российского центра информационных технологий и эпидемиологических исследований в области онкологии за 2015 г., ПКР был выявлен у 22 846 человек, что составило 3,9% от всех впервые выявленных опухолей различных локализаций, при этом смертность составила 8511 случаев. В течение 1 года число зарегистрированных в России новых случаев ПКР выросло почти на 5% [5]. Рост числа впервые выявленных новообразований во многом обусловлен улучшением диагностики за счет более широкого использования в клинической практике современных лучевых методов визуализации: УЗИ, МСКТ и МРТ. Благодаря этим методам стало возможным раннее выявление небольших опухолей (стадия T1) [3], как правило, протекающих бессимптомно (более чем у половины заболевших) [6, 7].
За последние годы возросла доля органосохраняющих пособий, которые стали применяться не только по абсолютным показаниям (опухоль единственной почки, двусторонние опухоли), а все чаще – по относительным и избирательным показаниям. Во всем мире наблюдается тенденция к снижению травматичности операций [4]. На сегодняшний день в ведущих урологических центрах мира не более 5% всех проводимых вмешательств открытые [8]. На фоне стремления к снижению инвазивности большую популярность набирает такая альтернатива хирургическому лечению, как криоаблация.
Впервые криоаблация рака почки была выполнена еще в 1974 г. в эксперименте на животных [9]. Однако ввиду технических трудностей (громоздкая конструкция криомашины, толстые криозонды и отсутствие контроля за проведением процедуры) метод не сумел обрести популярность. Технический прогресс и появление новых лучевых методов исследования в 1980-х гг. возродили интерес к криохирургии [10]. И уже в 1993 г. G. Onik и соавт. [11] опубликовали данные о контроле за процессом формирования ледяного шара при помощи ультразвука. А в 1994 г. английским ученым F. Lee были разработаны и применены температурные сенсоры, при помощи которых обеспечивалось точное достижение требуемой температуры [12]. Уже в 1995 г. в Японии доктором M. Uchida была выполнена чрескожная криоаблация опухоли почки человека [13]. Разрушение тканей во время криоаблации служит результатом двух последовательных этапов: этап заморозки – во внеклеточном пространстве формируются кристаллы льда, что ведет к росту осмотического давления; последнее вызывает активную диффузию жидкости из клеток, тем самым активируя процессы апоптоза; затем кристаллы льда формируются уже во внутриклеточном пространстве, потенцируя цитотоксический эффект; этап оттаивания – при оттаивании из-за повреждения клеточных структур возникают отек, окклюзия и тромбоз сосудов, что в итоге приводит к некрозу опухолевого образования [14, 15].

Криоаблация опухоли почки может быть выполнена разными доступами: открытым, лапароскопическим и чрескожным. Решение о конкретном виде доступа принимается с учетом локализации опухоли. Лучшие результаты криоаблации получены при экзофитном расположении опухоли (25% диаметра опухоли находится в паранефральной клетчатке) [16]. В настоящее время открытый доступ (ввиду своей травматичности) используется крайне редко [14, 17]. Для выполнения криоаблации под лапароскопическим контролем необходимы проведение интубационного наркоза и техническое обеспечение в виде лапароскопического ультразвукового датчика для оценки распространения ледяного шара [18].
В свою очередь чрескожная криоаблация может осуществляться под контролем ультразвука, КТ или МРТ [16]. Важно отметить, что при проведении операции под УЗ-контролем необходимо проводить визуализацию с нескольких точек, так как формирующийся ледяной шар в значительной мере снижает видимость [16, 19]. Безусловным достоинством чрескожного доступа является возможность выполнения операции под местной анестезией [20].
Цель работы: оценить эффективность и безопасность криоаблации опухоли почки под ультразвуковым контролем.
Материалы и методы. В исследовании приняли участие 12 пациентов в возрасте от 52 до 76 лет (средний возраст – 62,5 года), которым выполнялась чрескожная криодеструкция опухоли почки. Период наблюдения составил 8 мес. Все 12 вмешательств были выполнены одним хирургом.
У 11 пациентов ПКР соответствовал стадии Т1a (размер опухоли до 3 см), у 1 – стадии T1b (размер опухоли – 4,5 см). В 8 случаях опухоль локализовалась справа, в 4 – слева. На дооперационном этапе была проведена оценка характеристик опухоли по шкале PADUA (Preoperative aspects and dimensions used for ananatomical). У 8 пациентов она составила 6–7 баллов (низкая), у 3 – 8–9 (средняя) и у 1 – 10 (высокая). Криоаблация выполнялась с использованием криомашины 4-го поколения SeedNet Gold («Galil Medical») и криозондов IceSeed или IceRod диаметром 17-gauge. Наличие тех или иных криозондов обусловлено различием зон формирования ледяного шара.
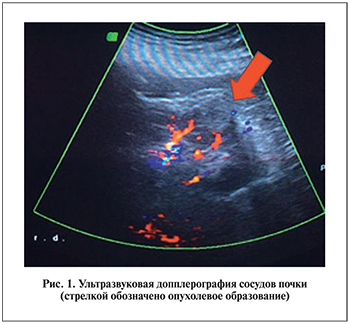
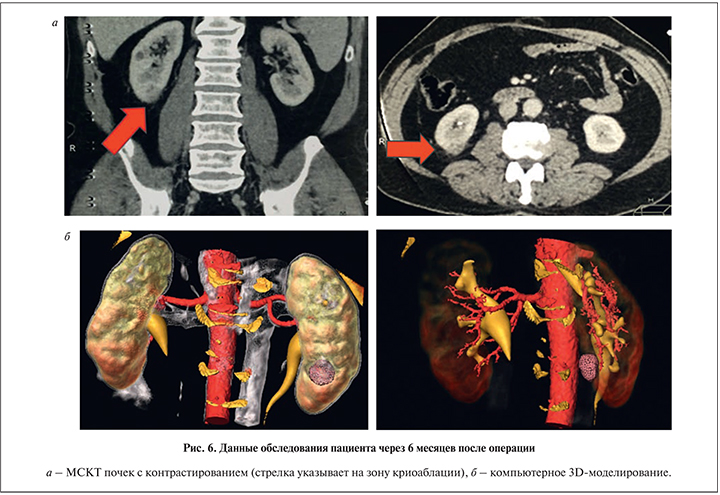
На этапе предоперационного обследования всем пациентам проводилось УЗИ с допплерографией (рис. 1). Во всех наблюдениях образования располагались по задней или латеральной поверхности почки в среднем или нижнем сегменте. Подобная локализация опухоли делает ее наиболее доступной для проведения криозондов. Помимо УЗИ каждому пациенту выполняли МСКТ почек с контрастированием (рис. 2) и компьютерное 3D-моделирование (рис. 3). Последнее позволяло оценить не только размер опухоли, но и распространенность опухолевого процесса, а также пространственное отношение внутренней поверхности опухолевого узла к элементам чашечно-лоханочной системы.
Операцию проводили в несколько этапов.
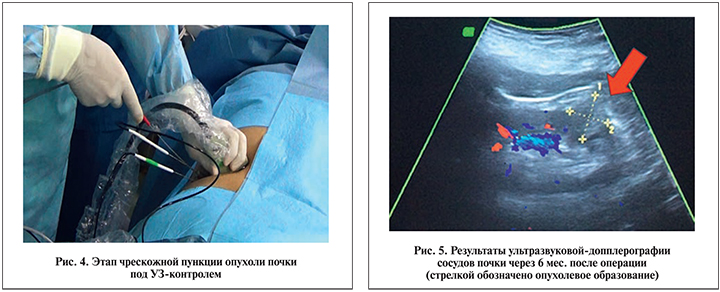
 На первом этапе нами осуществлялась интраоперационная ультразвуковая навигация и планирование расположения зондов в опухоли. Затем выполнялась пункционная биопсия образования. Во всех 12 случаях наличие ПКР было подтверждено гистологически. Далее проводилось тестирование криозондов. Его целью стала оценка работоспособности зондов и адекватность подачи газов. Четвертый этап операции заключался в проведении криозондов в опухолевый очаг. В среднем на установку одного зонда уходило 5–8 мин (рис. 4). Далее следовал этап контрольного ультразвукового мониторинга и оценки правильности установки зондов. Этап аблации заключался в подаче по криозондам аргона, который в соответствии с эффектом Джоуля–Томсона, расширяясь по мере выхода в ткани, охлаждал их до температуры от -40 до -60°; при этом происходила заморозка опухоли и формировался ледяной шар. Для гарантированной аблации опухолевой ткани зона ледяного шара должна (визуально) распространиться на 3–5 мм за границы опухоли. Длительность этапа составила 10 мин. Затем наступал цикл пассивной разморозки длительностью около 6 мин; подача газов отсутствовала; проходило пассивное снижение температуры. Далее следовал цикл активной разморозки длительностью примерно 2 мин; при этом по зондам начиналась подача гелия, который (в соответствии с вышеописанным эффектом) поднимал температуру тканей до нормальных значений.
На первом этапе нами осуществлялась интраоперационная ультразвуковая навигация и планирование расположения зондов в опухоли. Затем выполнялась пункционная биопсия образования. Во всех 12 случаях наличие ПКР было подтверждено гистологически. Далее проводилось тестирование криозондов. Его целью стала оценка работоспособности зондов и адекватность подачи газов. Четвертый этап операции заключался в проведении криозондов в опухолевый очаг. В среднем на установку одного зонда уходило 5–8 мин (рис. 4). Далее следовал этап контрольного ультразвукового мониторинга и оценки правильности установки зондов. Этап аблации заключался в подаче по криозондам аргона, который в соответствии с эффектом Джоуля–Томсона, расширяясь по мере выхода в ткани, охлаждал их до температуры от -40 до -60°; при этом происходила заморозка опухоли и формировался ледяной шар. Для гарантированной аблации опухолевой ткани зона ледяного шара должна (визуально) распространиться на 3–5 мм за границы опухоли. Длительность этапа составила 10 мин. Затем наступал цикл пассивной разморозки длительностью около 6 мин; подача газов отсутствовала; проходило пассивное снижение температуры. Далее следовал цикл активной разморозки длительностью примерно 2 мин; при этом по зондам начиналась подача гелия, который (в соответствии с вышеописанным эффектом) поднимал температуру тканей до нормальных значений.
Результаты. Продолжительность криоаблации в среднем составила 60 мин (от 48 до 85 мин). Одна операция была выполнена под эндотрахеальным наркозом, 6 – под спинномозговой анестезией, 5 – под местной (в качестве местного анестетика использовали раствор ропивакаина гидрохлорида 2 мг/мл объемом 50 мл) и 1 – под внутривенной анестезией.
При ультразвуковом обследовании через 6 мес после операции у 11 пациентов со стадией Т1а объем образований уменьшился в среднем на 8 мм.
Структура образований изменилась, став более гиперэхогенной. Данные эходопплерографии указывали на отсутствие кровотока в их проекции (рис. 5).
При МСКТ и 3D-моделировании также отмечалось уменьшение образований в размере. Более того, градиент накопления контрастного препарата либо отсутствовал, либо не превышал 10 HU (рис. 6 а, б).
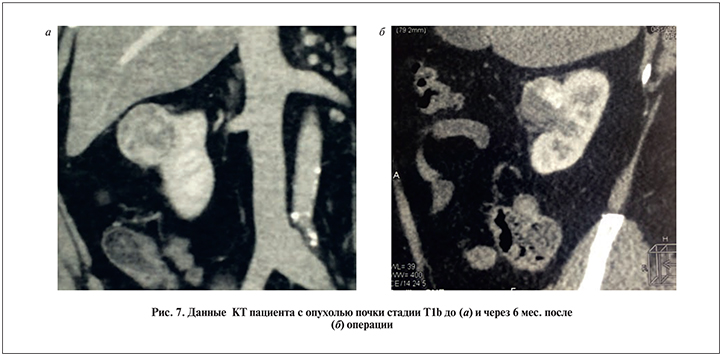
У пациента со стадией T1b (размер опухоли – 4,5 см), по данным УЗИ и МСКТ, через 6 мес после операции отмечено уменьшение опухоли в размере от 0,8 до 3,7 см; однако в ее проекции определялся участок размером до 1,5 см с высоким градиентом накопления контрастного препарата (100 HU; рис. 7).В дальнейшем пациенту была выполнена лапароскопическая резекция почки. Операция прошла без осложнений. Гистологическое заключение: зона низкодифференцированного светлоклеточного рака размером до 1,5 см с обширными зонами геморрагии и некроза.
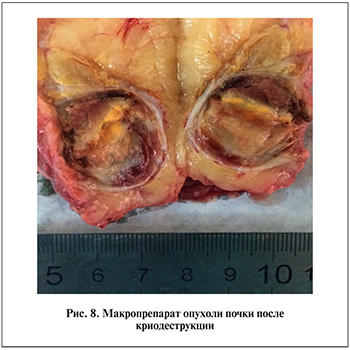
В зоне дна резекции опухолевого роста не обнаружено. В почечной паренхиме – признаки нефрогидроза, гиперемия клубочков, очаговая периваскулярная лимфоцитарная инфильтрация. Послеоперационный период протекал без особенностей (рис. 8). Нами не было отмечено послеоперационных осложнений тяжелее I степени по шкале Clavien–Dindo. Изменений в лабораторных показателях (креатинин, азот, мочевина) не выявлено. Экскреторная функция почек сохранена. В настоящее время продолжается наблюдение за пациентами с целью оценки общей и безрецидивной выживаемости, а также общих функциональных результатов.
Заключение. Чрескожная криоаблация под ультразвуковым контролем является эффективной и безопасной методикой лечения больных с опухолью почки стадии Т1а с локализацией по задней или латеральной поверхности в нижнем или среднем сегменте без инвазии в почечный синус. Несмотря на небольшое количество пациентов и относительно короткий период наблюдения, в нашей работе была продемонстрирована высокая эффективность криоаблации. Стоит отметить, что использованная нами шкала PADUA позволила оценить и систематизировать предоперационные показатели локализации опухоли (размер, отношение к чашечно-лоханочной системе, расположение, характер опухолевого процесса: экзофитный или эндофитный), однако требуется дальнейшая оценка ее эффективности (при планировании криоаблации).
В дальнейшем планируется продолжить наблюдение за всеми пациентами для оценки долгосрочной эффективности криоаблации.


