Введение. Крипторхизм – самая частая аномалия развития мужских гениталий, встречающаяся у 1–2% мальчиков в возрасте одного года [1, 2]. Среди всех форм крипторхизма на долю непальпируемых яичек приходится 20–27% [3, 4], из них истинно интраабдоминальные формы крипторхизма, в том числе и яички, расположенные у внутреннего пахового кольца, составляют, по разным данным, от 45,6 до 72,6% [4–8].
В основу принципов оперативного лечения абдоминальных форм крипторхизма положены результаты исследования Stephens и Fowler [9], обосновавших возможность пересечения яичковых сосудов в силу недостаточной их длины для низведения яичка в мошонку. Реализация этого принципа на практике сопровождалась довольно высокой частотой (33,3%) развития тестикулярной атрофии в послеоперационном периоде, что определило необходимость поиска путей совершенствования оперативных технологий. В 1976 г. N. Cortesi и соавт. [10] предложили выполнение диагностической лапароскопии для уточнения анатомии и качества задержанного яичка, а также выбора тактики ведения пациентов. В середине 1980-х гг. P. Ransley и соавт. [11] опубликовали результаты первого опыта проведения операции Фовлера–Стефенса в два этапа: на первом этапе выполнено легирование семенных артерий, на втором – мобилизация яичка с дальнейшим его низведением. Авторы полагали, что легирование сосудов без дальнейшей мобилизации должно простимулировать усиление коллатерального кровотока, что позволит повысить жизнеспособность низведенного яичка, поэтому второй этап осуществлен спустя 6 мес. Методика позволила заметно снизить частоту тестикулярной атрофии. Так, по их данным, в выборке, которая составила 13 пациентов, подобных осложнений не наблюдали.
Опираясь на уже накопленные к тому времени знания, в 1991 г. D. Bloom [12] предложил и описал лапароскопическое выполнение первого этапа операции Фовлера–Стефенса, в ходе которого уточнена анатомия крипторхического яичка и проведено лигирование сосудов. Годом позже J. Elder и соавт. [13] сообщили об использовании лапароскопического доступа при выполнении и второго этапа данной операции.
В конце 1990-х гг. появились данные [14, 15], свидетельствующие о возможности низведения абдоминального яичка без пересечения тестикулярных сосудов. Методика привлекала внимание низкой частотой развития тестикулярной атрофии, однако ее использование оказалось ограниченным при выраженном дефиците длины яичковых сосудов.
Совершенствование технологии выполнения второго этапа операции позволило добиться снижения частоты послеоперационной атрофии яичка с 20 [5] до 15% [16]. Однако технологические ресурсы улучшения результатов оперативного лечения крипторхизма, на наш взгляд, далеко не исчерпаны.
Материалы и методы. В течение 2006–2013 гг. в клинике были прооперированы 167 мальчиков с крипторхизмом (209 непальпируемых яичек). Односторонний крипторхизм имел место у 125 (74,9%) детей (слева у 48 [38,4%], справа у 77 [61,6%]), двусторонний – 42 (25,1%). Средний возраст составил 53,7±34,7 мес. Во время выполнения первого этапа операции Фовлера–Стефенса было выявлено 97 (46,4%) абдоминально расположенных яичек, в том числе и яички, расположенные у внутреннего пахового кольца. Среди них длинная петля протока была обнаружена у 29 (29,9%) яичек, для 36 (37,1%) гонад было невозможно достоверно исключить ее наличие, облитерированный влагалищный отросток выявлен в 3 (3,1%) случаях.
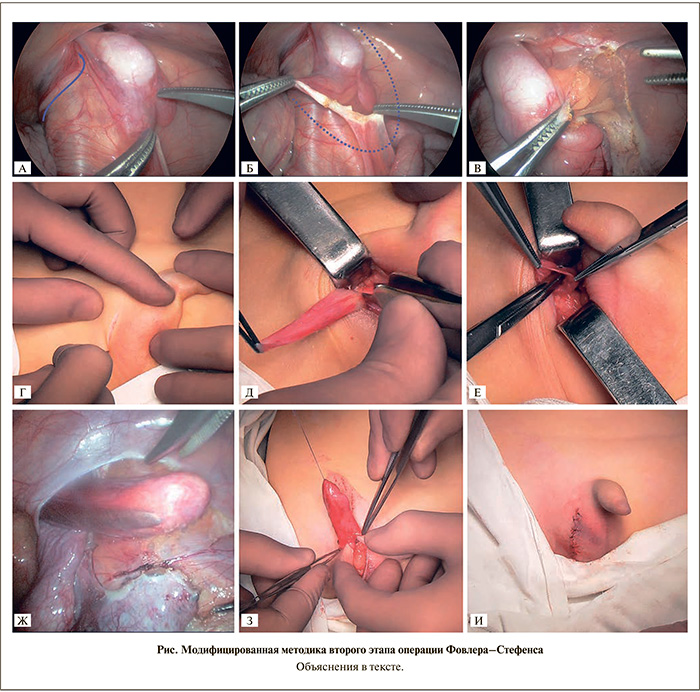
Через 6 мес в зависимости от методики низведения тестикулы в ходе второго этапа операции Фовлера–Стефенса пациенты были разделены на две группы. В 1-ю группу включены 27 (34 яичка) мальчиков, которым второй этап операции выполнен стандартно с использованием лапароскопического доступа [17]. В эту группу включены все пациенты с облитерированным влагалищным отростком брюшины. Во 2-ю группу вошел 51 (63 гонады) мальчик, у которого при выполнении второго этапа операции Фовлера–Стефенса использована модифицированная нами методика: после лапароскопической ревизии брюшной полости уточнена анатомия крипторхического яичка и наличие длинной петли протока (см. рис. а), произведена мобилизация яичка с лоскутом париетальной брюшины (см. рис. б, в), выполнена скрототомия на ипсилатеральной стороне (см. рис. г) с последующей мобилизацией влагалищного отростка брюшины до внутреннего кольца пахового канала (см. рис. д), вворачивали влагалищный отросток в брюшную полость (см. рис. е), завершена лапароскопически мобилизация влагалищного отростка (см. рис. ж), сформирован новый канал в медиальной ингвинальной ямке ипсилатеральной стороны, через который в дальнейшем низведено яичко в мошонку. Открытым способом произведено погружение яичка во вновь вывернутый влагалищный отросток брюшины (см. рис. з) и орхидопексия за счет ушивания мясистой оболочки вокруг элементов семенного канатика. Лапароскопическая часть операции завершена закрытием дефекта брюшины, открытая – послойным ушиванием раны (см. рис. и).
Интраоперационно определены длина (A), ширина (B) и толщина (C) яичка; его объем рассчитан по формуле: V=0,71•A•B•C.
В послеоперационном периоде объем гонад определен с помощью орхидометра Прадера.
При сравнении двух групп пациентов учтен объем тестикул, измеренный интраоперационно и через 6 мес после операции, и положение гонад после их низведения. Уменьшение размера яичка более чем на 10% от интраоперационного считали признаком тестикулярной атрофии. Полной атрофией считали случаи, когда пальпаторно достоверно тестикулярная ткань не определялась. При оценке положения яичка различали нормальное положение яичка (на дне мошонки) и высокое (в области основания мошонки). Из анализа был исключен 1 пациент 1-й группы и 2 – 2-й в связи с выходом из мониторинга. Статистический анализ выполняли с использованием критерия χ2.
Результаты. Наблюдения за больными в послеоперационном периоде показали, что у пациентов, у которых через 6 мес обнаруживали снижение тестикулярного объема яичка свыше 10% от интраоперационного показателя, со временем во всех случаях атрофия прогрессировала до полной. Это позволило нам при сравнении частоты тестикулярной атрофии в обеих группах суммировать случаи частичной и полной атрофии.
Результаты лечения пациентов представлены в таблице.
Тестикулярная атрофия выявлена у 5 (15,2%) пациентов 1-й группы, из них у 4 с унилатеральной, у 1 – с билатеральной формами. Во 2-й группе атрофия яичка имела место в 2 (3,3%) случаях при односторонней форме крипторхизма (p<0,05). Несмотря на то что в обеих группах более чем у 6% пациентов выявлено высокое расположение низведенного яичка в мошонке, мы не сочли необходимым выполнять повторные вмешательства с целью смещения тестикул на дно мошонки.

Обсуждение. Технология операции Фовлера–Стефенса, предусматривающая полное выключение кровотока по основным магистралям, требует максимального сохранения кровотока по артериям семявыносящего протока, тесно связанным с самим протоком. В литературе мы обнаружили несколько публикаций, посвященных проблеме наличия длинной петли семявыносящего протока. Так, S. Dave и соавт. [18] сообщают: данная анатомическая конфигурация встречается с частотой 15,1%. Следует заметить, что при наличии длинной петли протока и лапароскопическом выполнении операции Фовлера–Стефенса тестикулярная атрофия имеет место в 83% случаев [18]. В работе [19] приводится еще более высокая частота петли семявыносящего протока – 28,1%, а также подчеркивается, что при выполнении стандартной операции Фовлера–Стефенса возможно ятрогенное повреждение сосуда. В нашей когорте пациентов петля протока достоверно была выявлена в 29,9% случаев, а в 37,1% наблюдений мы не могли исключить ее наличие. Таким образом, риск повреждения единственного сохраненного после первого этапа пути кровоснабжения яичка в момент мобилизации у внутреннего кольца пахового канала присутствует у примерно 50% пациентов. Связано это с тем, что мобилизация vas deferens при глубоком вхождении его петли в паховый канал с использованием лапароскопического доступа является, как правило, технически трудной и длительной процедурой.
Необлитерированный влагалищный отросток брюшины встречается в 88% случаев интраабдоминального расположения яичек [20]. Использование скротального доступа для мобилизации влагалищного отростка париетальной брюшины, с нашей точки зрения, существенно снижает риск повреждения артерий семявыносящего протока. Полученные нами данные во 2-й группе пациентов демонстрируют достоверное снижение частоты тестикулярной атрофии по сравнению с классической техникой операции Фовлера–Стефенса. Мы убеждены в том, что скротальный подход обеспечивает менее травматичный и технически более легкий способ мобилизации вагинального отростка брюшины, а вместе с ней и семявыносящего протока, особенно при наличии его длинной петли. Учтя абсолютную необходимость выполнения скрототомии при любых вариантах низведения яичка, мы предлагаем при наличии необлитерированного влагалищного отростка брюшины вне зависимости от длины петли протока производить его мобилизацию через скротальный доступ в ходе второго этапа операции Фовлера–Стефенса. Использование предложенного подхода упрощает мобилизацию яичка и позволяет снижать частоту последующей тестикулярной атрофии.


