Введение. Радикальная цистэктомия остается «золотым» стандартом в лечении мышечноинвазивного рака мочевого пузыря (T2–T4a, N0–Nx, M0), поверхностного рака мочевого пузыря высокой степени злокачественности (T1G3), при БЦЖ-резистентном раке in situ (Tis) [1]. Показанием к выполнению простой цистэктомии являются микроцистис как исход длительного надлобкового дренирования, интерстициального цистита или туберкулеза мочеполовых органов, нейрогенный мочевой пузырь, экстрофия мочевого пузыря.
После цистэктомии деривацию мочи можно обеспечить с помощью инконтинентных и континентных кишечных пластик [2].
Важнейшим этапом при кишечной деривации мочи после радикальной или простой цистэктомии является формирование уретероинтестинального анастомоза. Его значимость обусловлена главным требованием к формируемому механизму отведения мочи – сохранение интактных верхних мочевых путей [3, 4]. В настоящее время доказано, что повторяющийся резервуарно-мочеточниковый рефлюкс инфицированной мочи, равно как и уретерогидронефроз на фоне стриктуры мочеточника, является причиной прогрессирующей почечной недостаточности [5–9].
На протяжении более 150 лет антирефлюксная защита верхних мочевых путей при кишечной деривации мочи считалась аксиомой [10, 11]. Однако в исследованиях последних лет доказано, что частота образования стриктур в случае применения прямых, рефлюксных, анастомозов в 2 раза меньше, чем при использовании антирефлюксных анастомозов, кроме того, отсутствует клинически значимый рефлюкс после кишечной континентной деривации мочи с прямыми анастомозами при условии формирования детубулированного резервуара низкого давления [12, 13].
С учетом данных литературы, свидетельствующих о более низкой частоте развития стриктур при прямых анастомозах по сравнению с антирефлюксными, начиная с 2003 г. мы используем исключительно прямые способы имплантации мочеточников в кишечный резервуар.
Целью работы было сравнить частоту осложнений, возникших при использовании прямых способов имплантации мочеточников в кишечный резервуар, после радикальной или простой цистэктомии.
Материалы и методы. Для ретроспективного исследования были отобраны 147 пациентов (116 [79,21%] мужчин и 31 [21,79%] женщина), которым в период с 2004 по 2014 г. была выполнена кишечная деривация мочи после радикальной и простой цистэктомии. Из них 59% деривацию мочи осуществляли по Bricker, 33% – по Studer и 8% – по Hautmann. Средний возраст пациентов составил 54,2±3,0 (36–69) года.
Радикальная цистэктомия по поводу рака мочевого пузыря произведена 126 пациентам. Распределение по стадиям заболевания, согласно классификации TNM, представлено в табл. 1.
 Простая цистэктомия выполнена при следующих заболеваниях: сложные постлучевые пузырно-влагалищные свищи с потерей емкости мочевого пузыря, интерстициальный цистит и мочеполовой туберкулез с исходом в микроцистис (табл. 2).
Простая цистэктомия выполнена при следующих заболеваниях: сложные постлучевые пузырно-влагалищные свищи с потерей емкости мочевого пузыря, интерстициальный цистит и мочеполовой туберкулез с исходом в микроцистис (табл. 2).
Из нашей выборки были исключены больные диабетом, с системными нарушениями метаболизма и пациенты с предварительно выполненной нефруретерэктомией.
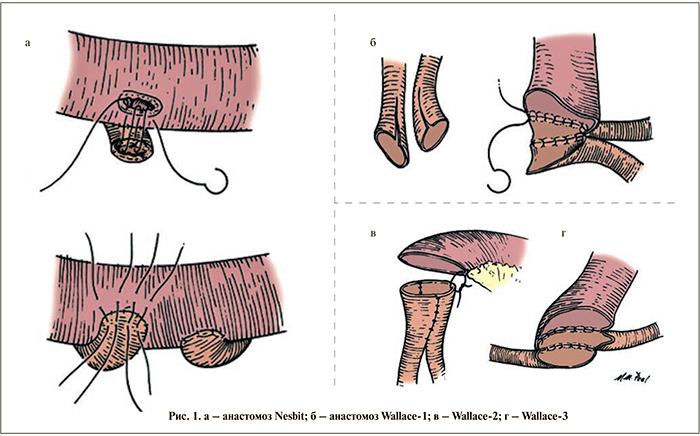
Всем пациентам выполнены прямые уретероинтестинальные анастомозы по Nesbit (рис. 1, а), Wallace-1 и Wallace-2 (рис. 1: Wallace-1 – б, Wallace-2 – в, Wallace-3 – г).
Пациенты были разделены на две группы: в 1-й группе 60 (40,81%) пациентам был выполнен прямой уретероинтестинальный анастомоз по Nesbit, во 2-й 87 (59,19%) больным – анастомоз по Wallace-1 и Wallace-2. При всех уретероинтестинальных анастомозах дренирование верхних мочевых путей осуществлено наружными мочеточниковыми стентами. Борьбу с инфекцией начали на стадии предоперационной подготовки интестинального тракта профилактическим приемом цефалоспоринов II поколения.
Источником сведений о наблюдаемых пациентах послужили регулярные обследования, включившие определение уровня сывороточного креатинина, электролитов, кислотно-основного состояния крови, ультрасонографию верхних и нижних мочевых путей, обзорную и экскреторную урографию, КТ, МРТ, радиоизотопную динамическую нефросцинтиграфию, при необходимости – ретроградную резервуарографию. Средний срок наблюдения составил 5,6 (2–10) года.
При статистической обработке использован тест Колмогорова–Смирнова, t-тест Student.
Результаты. В 1-й группе при использовании методики имплантации мочеточника по Nesbit у 2 (3,38%) пациентов диагностирован односторонний уретерогидронефроз. Во 2-й группе при использовании методики по Wallace-1 и Wallace-2 только у 1 (1,14%) пациента выявлен двусторонний уретерогидронефроз на фоне стриктуры в зоне уретероинтестинального анастомоза. Различия в частоте развития данного осложнения в группах оказались статистически незначимыми (p>0,05). В обеих группах пациентам со стриктурами уретероинтестинального анастомоза выполнен реанастомоз.
Максимальная концентрация сывороточного креатинина в обеих группах оперированных пациентов составила 231 мкмоль/л. По данным радиоизотопной нефросцинтиграфии различий в накопительно-выделительной функции почек в двух группах пациентов не зафиксировано. За время наблюдения случаев образования камней в почках и мочеточникового рефлюкса выше 3-й степени ни в той, ни в другой группе отмечено не было. Клиническая манифестация мочеточниково-резервуарного рефлюкса имела место у 3 пациентов 1-й группы и у 2 – 2-й.
Приводим клинические наблюдения.
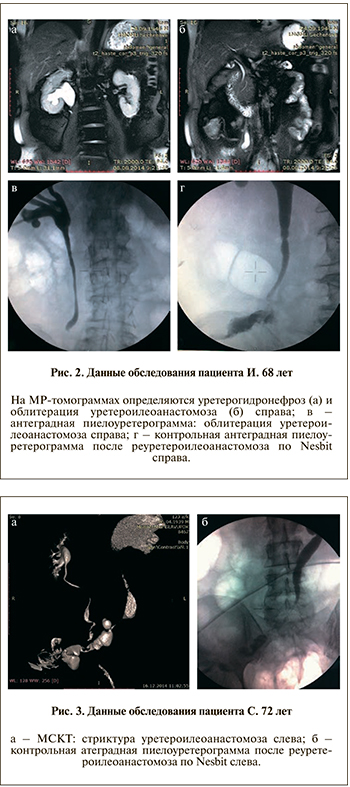
П а ц и е н т И. 68 лет. 12.02.14 в клинике Дельменсхорст (Бремен, Германия) по поводу мышечно-инвазивного рака мочевого пузыря T3аN0M0 перенес радикальную цистэктомию, операцию Briсker. Через 6 мес после операции по данным МРТ у пациента выявлены уретерогидронефроз справа (рис. 2, а), облитерация уретероилеоанастомоза справа (рис. 2, б). 4.08.14 в 21-м урологическом отделении ГКБ им С. П. Боткина пациенту в связи с обструктивным пиелонефритом справа выполнена чрескожная пункционная нефростомия с антеградной пиелоуретерографией, по данным которой определена облитерация уретероилеоанастомоза справа (рис. 2, в). 20.11.14 в нашей клинике пациенту выполнена операция релапаротомии, реуретероилеоанастомоз по Nesbit справа. При контрольном обследовании (рис. 2, г) анастомоз состоятелен, нефростома удалена, пациент в удовлетворительном состоянии выписан из клиники.
П а ц и е н т С. 72 лет. 24.05.11 в 21-м урологическом отделении ГКБ им. С. П. Боткина по поводу мышечно-инвазивного рака мочевого пузыря pT2bN0M0 проведена радикальная цистэктомия, операция Briсker, уретероилеоанастомоз выполнен инвагинационным методом.
В ноябре 2014 г. по данным МСКТ у пациента выявлена стриктура уретероилеоанастомоза слева (рис. 3, а). 10.12.14 пациенту выполнена чрескожная пункционная нефростомия слева. 15.01.15 проведена операция релапаротомии, реуретероилеоанастомоз слева по Nesbit. При контрольном обследовании (рис. 3, б) анастомоз состоятелен, нефростома удалена, пациент в удовлетворительном состоянии выписан из клиники.
Обсуждение. По мнению U. Studer и соавт. [14], развитие стриктуры уретероинтестинального анастомоза является тяжелым осложнением, которое приводит к снижению функции почек, развитию ХПН и метаболического ацидоза. Частота развития стриктуры уретероинтестинального анастомоза при формировании кондуита либо резервуара, по различным данным, варьируется от 0 до 10% [15]. A. Le Duс [16] приводит следующие причины стриктуры анастомоза: наложение анастомоза в условиях натяжения, перекручивание и перегиб мочеточника, нарушение кровообращения в стенке мочеточника, образование гематом и мочевых затеков в месте имплантации, склероз стенки мочеточника. Основной причиной развития стенозов кишечно-мочеточниковых анастомозов R. Hautmann [17] считает ишемию стенки мочеточника и до 1998 г. отдавал предпочтение технике анастомоза по Le Duс, при которой частота стеноза достигала 9%. Затем в его клинике стали применять методику имплантации мочеточников в приводящую и отводящую петли подвздошной кишки, что позволило снизить частоту стенозов до 1%. Тот же автор [18] отмечает, что частота развития стриктуры анастомоза при антирефлюксной имплантации мочеточников по крайней мере в два раза выше, чем при прямом анастомозе мочеточников с кишкой. Той же точки зрения придерживаются P. Perimenis и соавт. [19].
Как уже указывалось выше, в настоящее время остается спорным вопрос о необходимости выполнения антирефлюксной защиты для сохранения функции почек. В проспективном рандомизированном исследовании [20], посвященном оценке илеокондуита и колонокондуита, в котором один мочеточник имплантировался по антирефлюксной методике, другой – без антирефлюксной зашиты, через 10 лет наблюдения различий показателей клубочковой фильтрации выявлено не было. В нашей выборке соблюдались принципы максимального сохранения васкуляризации мочеточника.
W. McDougal [21] показал, что методика Wallace обеспечивает наименьший процент стенозов в зоне анастомоза (до 3%), почечной недостаточности (до 4%), мочевых затеков в зоне анастомоза (до 2%).
Заключение. Проанализировав накопленный 10-летний опыт применения прямых способов имплантации мочеточника в кишечный резервуар, мы пришли к следующему выводу: прямая имплантация является простой и не требующей длительного времени методикой, при которой частота образования стриктуры в зоне уретероинтестинального анастомоза не превышает 2%. Опираясь на результаты нашего исследования, мы утверждаем, что прямые способы имплантации мочеточников могут быть использованы как при инконтинетной, так и при континентной кишечной деривации мочи с формированием ортотопических и гетеротопических кишечных резервуаров. С учетом минимального риска возникновения стриктуры в зоне анастомоза и низкой частоты манифестации рефлюкс-пиелонефрита при континетной деривации мочи с формированием кишечного резервуара низкого давления с использованием прямых уретеро-резервуаных анастомозов мы не видим показаний к выполнению антирефлюксной зашиты.


